题目内容
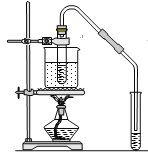
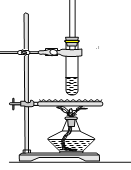
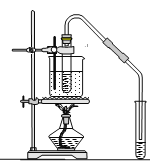
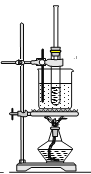
【题目】工业上以钛铁矿[主要成分为钛酸亚铁(FeTiO3),含有MgO、SiO2 等杂质]为原料,制备金属钛和铁红的工艺流程如下:已知:①酸溶时,FeTiO3转化为Fe2+和TiO2+;②本实验温度下,Ksp[Mg(OH)2]= 1.0×10-11;请回答下列问题:
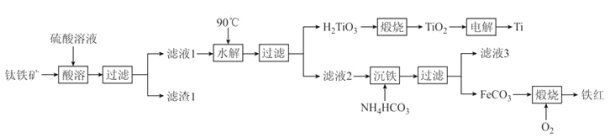
(1)FeTiO3中Ti元素的化合价为_______价。铁红的用途为________________(任写一种)。
(2)“水解”中,发生反应的离子方程式为____________________________________________。
(3)“沉铁”中,气态产物的电子式为_________;该过程需控制反应温度低于35℃,原因为_____________。
(4)FeCO3转化为铁红时,发生反应的化学方程式为________________________________________。
(5)滤液3可用于制备Mg(OH)2。若滤液3 中c(Mg2+)=1.2×10-4 mol·L-1,向其中加入等浓度等体积的NaOH溶液时,通过计算说明有无沉淀生成______________________________(溶液体积近似叠加)。
(6)电解生产钛时用TiO2和石墨做电极,电解质为熔融的CaO,则阴极反应式为__________________。
【答案】+4 制备红色颜料和油漆、冶炼铁等 TiO2++2H2O=H2TiO3↓+2H+[或TiO2++2H2O=TiO(OH)2+2H+] ![]() 防止NH4HCO3分解(或减少Fe2+的水解) 4FeCO3+O2=2Fe2O3+4CO2 Q=2.16×10-13< 1.0×10-11,故没有沉淀 TiO2+4e-=Ti+2O2-
防止NH4HCO3分解(或减少Fe2+的水解) 4FeCO3+O2=2Fe2O3+4CO2 Q=2.16×10-13< 1.0×10-11,故没有沉淀 TiO2+4e-=Ti+2O2-
【解析】
(1)FeTiO3中铁和氧的化合价分别为+2和-2,判断Ti元素的化合价;铁红的用途为制备红色颜料和油漆、冶炼铁等;
(2)酸溶时,FeTiO3转化为Fe2+和TiO2+;TiO2+水解生成H2TiO3沉淀,据此写出离子方程式;
(3) “沉铁”中,亚铁离子与碳酸氢根离子发生反应生成碳酸亚铁沉淀和二氧化碳;该过程需控制反应温度低于35℃,温度过高 NH4HCO3会分解,而且会促进亚铁离子的水解;
(4) FeCO3在氧气中加热生成氧化铁和二氧化碳,据此写出反应的化学方程式;
(5) 根据该反应的浓度商QC与 Ksp[Mg(OH)2]之间关系判断反应是否有沉淀生成;
(6)电解池中,TiO2在阴极发生还原反应生成钛,熔融的CaO为电解质,据此写出阴极反应。
(1)FeTiO3中铁和氧的化合价分别为+2和-2,所以Ti元素的化合价为+4价;铁红的用途为制备红色颜料和油漆、冶炼铁等;综上所述,本题答案是:+4; 制备红色颜料和油漆、冶炼铁等。
(2) 酸溶时,FeTiO3转化为Fe2+和TiO2+;TiO2+水解生成H2TiO3沉淀;离子方程式为:TiO2++2H2O=H2TiO3↓+2H+[或TiO2++2H2O=TiO(OH)2+2H+];综上所述,本题答案是:TiO2++2H2O=H2TiO3↓+2H+[或TiO2++2H2O=TiO(OH)2+2H+]。
(3) “沉铁”中,亚铁离子与碳酸氢根离子发生反应生成碳酸亚铁沉淀和二氧化碳,二氧化碳为共价化合物,电子式为:![]() ;该过程需控制反应温度低于35℃,温度过高 NH4HCO3会分解,而且会促进亚铁离子的水解,所以控制反应温度低于35℃是为了防止 NH4HCO3分解(或减少Fe2+的水解;综上所述。本题答案是:
;该过程需控制反应温度低于35℃,温度过高 NH4HCO3会分解,而且会促进亚铁离子的水解,所以控制反应温度低于35℃是为了防止 NH4HCO3分解(或减少Fe2+的水解;综上所述。本题答案是: ![]() ;防止NH4HCO3分解(或减少Fe2+的水解) 。
;防止NH4HCO3分解(或减少Fe2+的水解) 。
(4) FeCO3在氧气中加热生成氧化铁和二氧化碳,反应的化学方程式为:4FeCO3+O2=2Fe2O3+4CO2;综上所述,本题答案是:4FeCO3+O2=2Fe2O3+4CO2。
(5) 若滤液3中c(Mg2+)=1.2×10-4 mol·L-1,则NaOH溶液的浓度为1.2×10-4 mol·L-1,而溶液等体积混合,所以c(Mg2+)=c(OH-)=0.6×10-4 mol·L-1,该反应的浓度商QC= c(Mg2+)×c2(OH-)=2.16×10-13< Ksp[Mg(OH)2]= 1.0×10-11;所以没有沉淀生成;综上所述,本题答案是:Q=2.16×10-13< 1.0×10-11,故没有沉淀。
(6)电解池中,TiO2在阴极发生还原反应生成钛,熔融的CaO为电解质,阴极反应式为TiO2+4e-=Ti+2O2-;综上所述,本题答案是:TiO2+4e-=Ti+2O2-。

【题目】锰及其化合物在工农业生产和科技领域具有广泛的应用。
Ⅰ.溶液中的Mn2+可被酸性(NH4)2S2O8溶液氧化为MnO4-,该方法可用于检验Mn2+。
(1)用酸性(NH4)2S2O8溶液检验Mn2+时的实验现象为________________________。
(2)该反应的离子方程式为_____________________。
(3)(NH4)2S2O8可视为由两分子琉酸缩合所得,若硫酸的结构简式为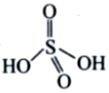 ,则H2S2O8的结构简式为 ________________。
,则H2S2O8的结构简式为 ________________。
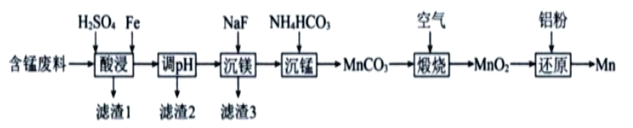
Ⅱ.实验室用含锰废料(主要成分为MnO2,还含有少量Al2O3、MgO、SiO2)为原料制备Mn的工艺流程如下图所示。
已知:①部分难溶物的溶度积常数如下表所示。
难溶物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 | Mn(OH)2 |
溶度积常数 | 4.0×10-38 | 1.0×10-33 | 1.8×10-11 | 1.8×10-13 |
②当溶液中离子浓度≤1.0×10-5mol L-1时,可认为该离子沉淀完全。
(1)“酸浸”时,MnO2将Fe氧化为Fe3+,该反应的离子方程式为________________________;该过程中浸出时间和液固比对锰浸出率的影响分别如下图所示。

则适宜的浸出时间和液固比分别为____________、____________。
(2)若“酸浸”后所得滤液中c(Mn2+)=0.18molL-1,则应“调pH”的范围为________________________。
(3)“煅烧”反应中氧化剂与还原剂的物质的量之比为__________。“还原”时发生的置换反应在化学上又叫作__________。