题目内容
【题目】NH3及其盐都是重要的化工原料。
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为________。

(2)如图,装置进行NH3性质实验,A、B为体积相等的两个烧瓶。

①先打开旋塞1,B瓶中的现象是___________________________,稳定后,关闭旋塞1;
②再打开旋塞2,B瓶中的现象是___________________________。
(3)为了探究某一种因素对溶液中NH4Cl水解程度的影响,限制使用的试剂与仪器为固体NH4Cl,蒸馏水、100mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、PH计、温度计、恒温水浴槽(可控制温度),某同学拟定了如下实验表格:

①该同学的实验目的是探究_____________对溶液中NH4Cl水解程度的影响。
②按实验序号1所拟数据计算NH4Cl水解反应的平衡转化率为___________(只列出算式,忽略水自身电离的影响)。
【答案】ACG 产生白色的烟 烧杯中的石蕊水溶液会倒流进入B瓶中,且溶液变红 温度 5.35×10-y×100%
【解析】
(1)固固加热制备气体,应选用A为发生装置;氨气密度比空气小,可采用C收集气体;氨气极易溶于水,为防止倒吸选用G进行尾气处理;选ACG;综上所述,本题答案是:ACG。
(2)①A瓶中压强比B瓶中压强大,打开旋塞1,氯化氢气体进入B瓶并与氨气反应生成氯化铵,B瓶中产生白烟;综上所述,本题答案是:产生白色的烟。
②反应后B瓶中压强减小,关闭旋塞1,打开旋塞2 ,烧杯中的石蕊溶液倒吸进B瓶,因为B瓶中氯化氢剩余,得到的溶液显酸性,溶液变红色;综上所述,本题答案是:烧杯中的石蕊水溶液会倒流进入B瓶中,且溶液变红。
(3)①从图表信息可知:该同学的实验目的是探究温度对溶液中NH4Cl水解程度的影响;综上所述,本题答案是:温度。
②由题可知,读取的待测物理量pH值为Y,则氢离子的物质的量浓度为10-Ymol/L,溶液的总体积为100mL,NH4Cl的质量为mg,其物质的量为m/53.5mol,故平衡转化率为10-Y×0.1/ (m/53.5)= 5.35×10-y×100%;综上所述,本题答案是:5.35×10-y×100%。

 同步练习强化拓展系列答案
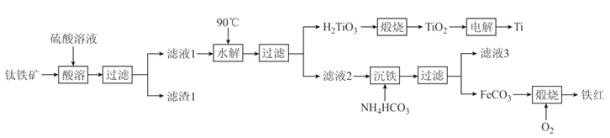
同步练习强化拓展系列答案【题目】金属钛(Ti)被誉为21世纪金属,具有良好的生物相容性,它兼具铁的高强度和铝的低密度。其单质和化合物具有广泛的应用价值。氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。以TiCl4为原料,经过一系列反应可以制得Ti3N4和纳米TiO2 (如图1)。

图中的M是短周期金属元素,M的部分电离能如下表:
I1 | I2 | I3 | I4 | I5 | |
电离能/kJ·mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
请回答下列问题:
(1)Ti的基态原子外围电子排布式为_______________。
(2)M是_______(填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为_______。
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示。化合物甲的分子中一个苯环的σ键有____个,化合物乙中碳,氧,氮三个原子对应的第一电离能由大到小的顺序为____________。


(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a×10-10 cm,则该氮化钛的密度为______ g·cm-3(NA为阿伏加德罗常数的值,只列计算式)。
(5)图3中Ti3+可形成配位数为6的空间构型,问它构成的立体构型为______面体。
【题目】根据下列实验操作和现象所得出的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体 | Na2O2没有变质 |
B | 取少许CH3CH2Br与NaOH溶液共热,冷却后滴加AgNO3溶液,最终无淡黄色沉淀 | CH3CH2Br没有水解 |
C | 室温下,用pH试纸测得:0.1 mol·L-1 Na2SO3溶液的pH约为10,0.1 mol·L-1 NaHSO3溶液的pH约为5 | HSO |
D | 向少量碘水中加入过量浓FeCl2溶液,分成两等份,向一份中滴加KSCN溶液显红色;向另一份中滴加淀粉溶液显蓝色 | Fe3+与I-的反应为可逆反应 |
A. AB. BC. CD. D
【题目】下列对文中描述内容的相关解释正确的是( )
选项 | 描述 | 解铎 |
A | 丹砂烧之成水银,积变又还成丹砂 | 两个反应互为可逆反应 |
B | 凡埏泥造瓦,掘地二尺余,择取无沙粘土而为之 | 其中“瓦”的主要成分为硅酸盐 |
C | 硝石(KNO3)如握盐雪不冰,强烧之,紫青烟起 | 产生“紫青烟”的原因为KNO3分解 |
D | 其法用浓酒精和槽入瓶,蒸令气上,用器承滴露 | 其中涉及的操作方法为蒸发浓缩 |
A. AB. BC. CD. D