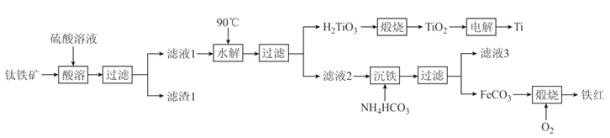
题目内容
【题目】已知:CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)。向恒容密闭容器中充入0.1molCH4和0.2molH2S,不断升高温度,测得平衡时体系中各物质的物质的量分数与温度的关系如图所示:
CS2(g)+4H2(g)。向恒容密闭容器中充入0.1molCH4和0.2molH2S,不断升高温度,测得平衡时体系中各物质的物质的量分数与温度的关系如图所示:

下列说法正确的是
A. 该反应的△H<0
B. 维持Z点温度,向容器中再充入CH4、H2S、CS2、H2各0.1mol时,v(正)>v(逆)
C. X点与Y点容器内压强比为51:55
D. X点CH4的转化率为20%
【答案】D
【解析】
A. 由图所示,CS2和H2的物质的量分数随温度升高而增大,故正反应是吸热反应,△H>0,故A错误;
B. 因为左边物料比右边少,维持Z点温度,向容器中再充入CH4、H2S、CS2、H2各0.1mol,相当于增大压强,平衡左移,故v(正)<v(逆),故B错误;
C. CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)
CS2(g)+4H2(g)
起(mol) 0.1 0.2 0 0
转(mol) x 2x x 4x
X点(mol) 0.1- x 0.2-2x x 4x
根据图像可知在X点时甲烷与氢气的体积分数相同,得出0.1- x=4x,x=0.02mol,所以X点时气体总物质的量为[(0.1- x)+ (0.2-2x )+ x+4x]=0.3+2x=0.34mol,
CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)
CS2(g)+4H2(g)
起(mol) 0.1 0.2 0 0
转(mol) y 2y y 4y
Y点(mol) 0.1- y 0.2-2y y 4y
根据图像可知Y点表示硫化氢与氢气的体积分数相同,所以0.2-2y=4y,y≈0.03mol,所以
Y点时气体总物质的量为[(0.1- y)+ (0.2-2y )+y+4y]=0.3+2y=0.36mol;如果温度一定,气体压强之比等于物质的量之比,压强比为0.34mol/0.36 mol=17:18,但X点温度低于Y点温度,温度升高,压强增大,故X点与Y点容器内压强之比小于此比值17:18,可能为51:55,故C错误;
D. CH4(g)+ 2H2S(g)![]() CS2(g)+4H2(g)
CS2(g)+4H2(g)
起(mol) 0.1 0.2 0 0
转(mol) x 2x x 4x
X点(mol)0.1- x 0.2-2x x 4x
根据图像可知在X点时甲烷与氢气的体积分数相同,0.1-x=4x,x=0.02mol,CH4的转化率0.02mol/0.1 mol×100%=20%,故D正确;
故选D。

 阅读快车系列答案
阅读快车系列答案