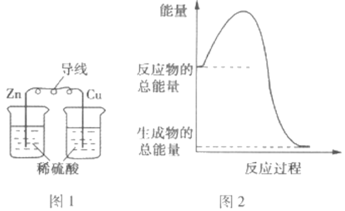
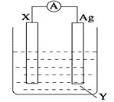
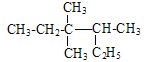��Ŀ����
����Ŀ��һ������ij�Ż�����(��Ҫ�ɷ�FexS��SΪ��2��)��100mL����ǡ����ȫ��Ӧ(��ʯ�������ɷֲ������ᷴӦ)������3.2g���ʡ�0.4molFeCl2��һ����H2S���壬����Һ����Fe3+��������˵����ȷ���ǣ� ��
A.����������ʵ���Ũ��Ϊ4.0mol��L-1
B.�ôŻ�����FexS�У�Fe2+��Fe3+�����ʵ���֮��Ϊ2��1
C.���ɵ�H2S�����ڱ�״���µ����Ϊ8.96L
D.�������FexS��x=0.85
���𰸡�C
��������
n(S)=3.2g��32g/mol=0.1mol������ת�Ƶ����غ��n(Fe3+)=![]() =0.2mol����n(Fe2+)=0.4mol-0.2mol=0.2mol������n(Fe2+)��n(Fe3+)=0.2mol��0.2mol=1��1���Դ˽����⡣
=0.2mol����n(Fe2+)=0.4mol-0.2mol=0.2mol������n(Fe2+)��n(Fe3+)=0.2mol��0.2mol=1��1���Դ˽����⡣
A.����ǡ�÷�Ӧ����FeCl2 �����ʵ���Ϊ0.4mol������Clԭ���غ�ɵ�c(HCl)=![]() =8.0mol/L��A����
=8.0mol/L��A����
B.�����Ϸ�����֪���ôŻ�����FexS�У�Fe2+��Fe3+�����ʵ���֮��n(Fe2+)��n(Fe3+)=1��1��B����
C.������ԭ�ӡ���ԭ���غ��n(H2S)=![]() n(HCl)=n(FeCl2)=0.4mol��V(H2S)=0.4mol��22.4L/mol=8.96 L��C��ȷ��
n(HCl)=n(FeCl2)=0.4mol��V(H2S)=0.4mol��22.4L/mol=8.96 L��C��ȷ��
D.FexS��n(S)=0.1mol+0.4mol=0.5mol��n(Fe)=0.4mol������n(Fe)��n(S)=0.4mol��0.5mol=0.8������x=0.8��D����
�ʺ���ѡ����C��

 ȫ�ܲ��һ���þ�ϵ�д�
ȫ�ܲ��һ���þ�ϵ�д�����Ŀ����ͼ��ʾ��ʵ������ȡ�����װ�ã����з���װ����ͬ������ͼ���װ�������ף��ֱ���ͼ1��ͼ2��ʾ������ѡ������ȷ���� ( )
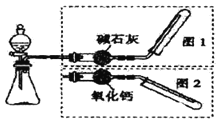
ѡ�� | ����װ���е�ҩƷ | ����ͼ���װ�� | |
A | �����������ƺ�Ũ���� | ͼ2 | |
B | ����ʯ��ϡ���� | ͼ1 | |
C | ͭ��ϡ���� | ͼ2 | |
D | �����ƺ�Ũ��ˮ | ͼ1 | |
A.AB.BC.CD.D