题目内容
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡.根据要求回答问题
(1)生活中明矾常作净水剂,其净水的原理是___________(用离子方程式表示).
(2)物质的量浓度相同的CH3COOH 溶液和NaOH 溶液混合后,溶液中c(CH3COO)=c(Na+),则CH3COOH 溶液的体积_____NaOH 溶液的体积.(填“大于”、“小于”或“等于”.)
(3)常温下,取0.2molL﹣1 HCl溶液与0.2molL﹣1 MOH溶液等体积混合,测得混合溶液后的pH=5.写出MOH的电离方程式:_______________________.
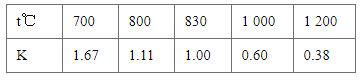
(4)含![]() 的废水毒性较大,某工厂废水中含5.0×10﹣3 molL﹣1的
的废水毒性较大,某工厂废水中含5.0×10﹣3 molL﹣1的![]() .为了使废水的排放达标,进行如下处理:
.为了使废水的排放达标,进行如下处理:
![]()
①绿矾为FeSO47H2O.反应(I)中Cr2O72﹣与FeSO4的物质的量之比为_____.
②常温下若处理后的废水中c(Cr3+)=6.0×10﹣7 molL﹣1,则处理后的废水的pH=_____(Ksp[Cr(OH)3]=6.0×10﹣31)
【答案】Al3++3H2OAl(OH)3+3H+ 大于 MOHM++OH﹣ 1:6 6
【解析】
(1)生活中明矾常作净水剂,铝离子水解生成氢氧化铝胶体,其净水的原理是Al3++3H2OAl(OH)3+3H+。
(2)物质的量浓度相同的CH3COOH 溶液和NaOH 溶液混合后,溶液中c(CH3COO)= c(Na+),说明溶液呈中性,如果是体积相等,则刚好反应生成醋酸钠,醋酸钠显碱性,要使得呈中性,说明酸的体积大于碱的体积,因此CH3COOH 溶液的体积大于NaOH 溶液的体积。
(3)常温下,取0.2molL﹣1 HCl溶液与0.2 molL﹣1 MOH溶液等体积混合,恰好生成MCl,该溶液后的pH=5,说明盐是强酸弱碱盐,水解显酸性,因此MOH为弱碱,其电离方程式:MOHM++OH-。
(4)①反应(I)中Cr2O72-与FeSO4的反应,Cr2O72-化合价从+6价变为+3价,1molCr2O72-转移6mol电子,FeSO4化合价从+2价升高为+3价,1molFeSO4转移1mol电子,根据转移电子数相等,物质的量之比为1:6.
②常温下若处理后的废水中c(Cr3+)=6.0×10﹣7 molL-1,![]() ,
,![]() ,则c(H+) = 1×10-6molL-1,则处理后的废水的pH=6。
,则c(H+) = 1×10-6molL-1,则处理后的废水的pH=6。
(1)生活中明矾常作净水剂,铝离子水解生成氢氧化铝胶体,其净水的原理是Al3++3H2OAl(OH)3+3H+,故答案为:Al3++3H2OAl(OH)3+3H+。
(2)物质的量浓度相同的CH3COOH 溶液和NaOH 溶液混合后,溶液中c(CH3COO)= c(Na+),说明溶液呈中性,如果是体积相等,则刚好反应生成醋酸钠,醋酸钠显碱性,要使得呈中性,说明酸的体积大于碱的体积,因此CH3COOH 溶液的体积大于NaOH 溶液的体积,故答案为:大于。
(3)常温下,取0.2molL﹣1 HCl溶液与0.2 molL﹣1 MOH溶液等体积混合,恰好生成MCl,该溶液后的pH=5,说明盐是强酸弱碱盐,水解显酸性,因此MOH为弱碱,其电离方程式:MOHM++OH-,故答案为:MOHM++OH-。
(4)①反应(I)中Cr2O72-与FeSO4的反应,Cr2O72-化合价从+6价变为+3价,1molCr2O72-转移6mol电子,FeSO4化合价从+2价升高为+3价,1molFeSO4转移1mol电子,根据转移电子数相等,物质的量之比为1:6,故答案为:1:6。
②常温下若处理后的废水中c(Cr3+)=6.0×10﹣7 molL-1,![]() ,
,![]() ,则c(H+) = 1×10-6molL-1,则处理后的废水的pH=6,故答案为:6。
,则c(H+) = 1×10-6molL-1,则处理后的废水的pH=6,故答案为:6。

【题目】氯化苄(C6H5CH2Cl)为无色液体,是一种重要的有机化工原料。现在实验室模拟工业上用甲苯与干燥氯气在光照条件下加热反应合成氯化苄、分离出氯化苄并检验样品的纯度,其装置(夹持装置略去)如图所示:

回答下列问题:
(1)仪器E的名称是_____________;其作用是_______________________________________。
(2)装置B中的溶液为___________________。
(3)用恒压滴液漏斗代替分液漏斗的优点是__________________________________________。
(4)装置A中反应的离子方程式为__________________________________________________。
(5)反应结束后,关闭K1和K2,打开K3,加热三颈烧瓶,分馏出氯化苄,应选择温度范围为______℃。
物质 | 溶解性 | 熔点(℃) | 沸点(℃) |
甲苯 | 极微溶于水,能与乙醇、乙醚等混溶 | -94.9 | 110 |
氯化苄 | 微溶于水,易溶于苯、甲苯等有机溶剂 | -39 | 178.8 |
二氯化苄 | 不溶于水,溶于乙醇、乙醚 | -16 | 205 |
三氯化苄 | 不溶于水,溶于乙醇、乙醚和苯 | -7 | 220 |
(6)检测氯化苄样品的纯度:
①称取13.00g样品于烧杯中,加入50.00mL 4 molL-1 NaOH水溶液,水浴加热1小时,冷却后加入35.00mL 40% HNO3,再将全部溶液转移到容量瓶中配成100mL溶液。取20.00mL溶液于试管中,加入足量的AgNO3溶液,充分振荡,过滤、洗涤、干燥,称量固体质量为2.87g,则该样品的纯度为_____%(结果保留小数点后1位)。
②实际测量结果可能偏高,原因是__________________________________________________。
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
[实验原理] 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
[实验内容及记录]
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是___________________________。
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=_____________________________。
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设。并继续进行实验探究。
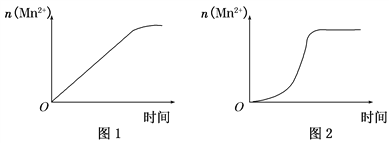
①该小组同学提出的假设是____________________________________。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L稀硫酸 | |||
4 | 3.0 | 2.0 | 3.0 | 2.0 | ________ | t |
③若该小组同学提出的假设成立,应观察到的现象是_________________________。