题目内容
【题目】近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
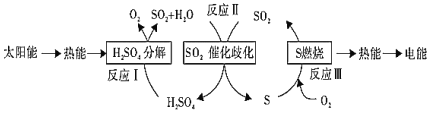
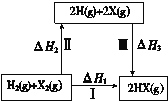
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)![]() SO2(g) ΔH3=-297 kJ·mol-1
SO2(g) ΔH3=-297 kJ·mol-1
写出反应Ⅱ的热化学方程式:_____________________。
(2)歧化反应可简单理解为化学反应中同一反应物中某元素化合价同时出现升降。已知I-离子可以作为水溶液中SO2歧化反应的催化剂。有关离子方程式如下(未配平):
a.SO2+I-+H+→S↓+I2+H2O
b.I2+H2O+SO2→SO42-+H++I-
i.依据图示及以上离子方程式a、b,写出SO2歧化反应方程式:______________。
ii.探究a、b反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
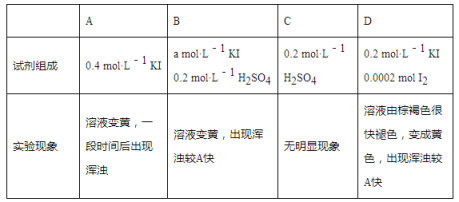
①B是A的对比实验,则a=__________。
②比较A、B、C,可得出的结论是______________________。
③实验表明,SO2的歧化反应速率D>A,结合①、②反应速率解释原因:________________。
【答案】3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) △H=-254 kJ/mol 3SO2+2H2O=2H2SO4+S↓ 0.4 I-是SO2歧化反应的催化剂,H+单独存在时不具有催化作用,但H+可以加快歧化反应速率 反应b比a快;D中由反应b产生的H+使反应a加快
【解析】
(1)根据盖斯定律,将已知的热化学方程式叠加,可得待求的反应的热化学方程式;
(2)i.根据电子守恒、原子守恒、电荷守恒,配平a、b两个方程式,然后叠加,可得SO2发生歧化反应的方程式;
ii.①B是A的对比实验,所用c(KI)应该相等;
②比较A、B、C,A中只含KI、B中含有KI和硫酸、C中只含硫酸,反应快慢顺序是B>A>C,且C中没有明显现象,说明不反应;
③反应a、b知,SO2先和I-反应生成I2,I2再和SO2进一步反应,D中KI溶液溶解了I2,根据实验现象对比分析。
(1) ①2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
②S(s)+O2(g)![]() SO2(g) ΔH3=-297 kJ·mol-1
SO2(g) ΔH3=-297 kJ·mol-1
-①-②,整理可得反应Ⅱ的热化学方程式为:3SO2(g)+2H2O(g)=2H2SO4(l)+S(s);△H=-254 kJ/mol;
(2) i.配平a、b两个方程式可得a.SO2+4I-+4H+→S↓+2I2+2H2O
b.I2+2H2O+SO2→SO42-+4H++2I-,由于I-离子可以作为水溶液中SO2歧化反应的催化剂,则a+2b,整理可得3SO2+2H2O=2H2SO4+S↓
ii.①B是A的对比实验,所用c(KI)应该相等,否则无法得出正确结论,所以a=0.4;
②比较A、B、C,A中只含KI、B中含有KI和硫酸、C中只含硫酸,反应快慢顺序是B>A>C,且C中没有明显现象,说明不反应,I-是该反应的催化剂,单独的H+不能具有催化作用,B中含有酸导致其反应速率加快,所以得出的结论是:I-是SO2歧化反应的催化剂,H+单独存在时不具有催化作用,但H+可以加快歧化反应速率;
③反应a、b知,SO2先和I-反应生成I2,I2再和SO2进一步反应,I-是该反应的催化剂,D中KI溶液溶解了I2,由D中“溶液的棕褐色很快褪色”说明反应b比反应a快,D的反应b中产生了H+,使反应a加快,所以SO2的歧化反应速率D>A。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案【题目】如图所示,利用培养皿进行实验。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。

下表中对实验现象所做的解释不正确的是( )
选项 | A | B | C | D |
实验 现象 | 浓盐酸附近产生白烟 | 浓硫酸附近无明显现象 | 干燥红色石蕊试纸不变色,湿润红色石蕊试纸变蓝 | 硫酸铜溶液变浑浊 |
解释 | NH3与HCl反应产生了NH4Cl固体 | NH3与浓硫酸不发生反应 | NH3与水反应生成了NH3·H2O,电离出OH-使红色石蕊试纸变蓝 | 生成Cu(OH)2沉淀 |
A.AB.BC.CD.D
【题目】POCl3常用作半导体掺杂剂及光导纤维原料,实验室制备POCl3并测定产品含量的实验过程如下:
I.制备PCl3
(1)实验室用高锰酸钾和浓盐酸反应制氯气。发生装置可以是图中的____(填字母代号)。
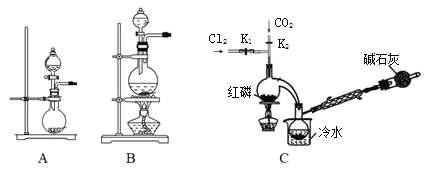
(2)检查装置C气密性并装入药品后,先关闭K1,打开K2通入干燥的CO2,一段时间后,关闭K2,加热曲颈瓶同时打开K1通入干燥氯气,反应立即进行。图中碱石灰的作用是______________。
II.实验室制备POCl3。
采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图:

资料:①Ag++SCN﹣=AgSCN↓,Ksp(AgCl)>Ksp(AgSCN);
②PCl3和POCl3的相关信息如下表:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | ﹣112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
POCl3 | 2.0 | 106.0 | 153.5 |
(3)POCl3在潮湿空气中会剧烈“发烟”,反应的化学方程式为___________________________________。
(4)反应温度要控制在60~65℃,原因是:_________________________________。
(5)通过佛尔哈德法可以测定产品中Cl元素含量,实验步骤如下:
a、准确称取15.0 g POCl3产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00 mL溶液。
b、取10.00 mL溶液于锥形瓶中,加入10.00 mL 3.2 molL﹣1 AgNO3标准溶液。
c、加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
d、以NH4Fe (SO4) 2为指示剂,用0.2 molL﹣1 NH4SCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去l0.00 mL NH4SCN溶液。
①步骤d中达到滴定终点的现象是__________________________________________。
②产品中Cl元素的质量分数为______________(保留3位有效数字)。