题目内容
【题目】甲、乙两烧杯中各盛有200mL3mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉质量为( )
A.10.8gB.7.2gC.5.4gD.3.6g
【答案】A
【解析】
铝与盐酸反应的化学方程式是2Al+6HCl═2AlCl3+3H2↑,铝与氢氧化钠反应的化学方程式是2Al+2NaOH+2H2O═2NaAlO2+3H2↑;根据题意,盐酸、氢氧化钠物质的量相等,若盐酸、氢氧化钠都完全反应,则生成气体体积比为V(甲)∶V(乙)=1∶3,若两份铝都完全反应,则生成氢气体积相等,实际生成氢气体积比V(甲)∶V(乙)=1∶2,说明乙中氢氧化钠有剩余、甲中铝有剩余。
盐酸和氢氧化钠溶液中溶质的物质的量均为0.2L×3mol/L=0.6mol,根据以上分析,甲中铝有剩余,盐酸完全反应,设铝与酸反应时生成的氢气的物质的量为xmol,
则 2Al+6HCl═2AlCl3+3H2↑
6 3
0.6mol x
![]() ,X=0.3mol,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则乙生成氢气的物质的量是0.6mol,设乙中参加反应的铝为ymol,
,X=0.3mol,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则乙生成氢气的物质的量是0.6mol,设乙中参加反应的铝为ymol,
则2Al+2NaOH+2H2O═2NaAlO2+3H2↑
2 3
y 0.6mol
![]() ,解得y=0.4mol,则铝的质量为0.4mol×27g/mol=10.8g;
,解得y=0.4mol,则铝的质量为0.4mol×27g/mol=10.8g;
故选A。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案【题目】Ⅰ.在锌与某浓度的盐酸反应的实验中,实验员得到下面的结果:
锌的质量(g) | 锌的形状 | 温度(℃) | 溶解于酸花的时间(s) | |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 35 | 50 |
E | 2 | 薄片 | 45 | 25 |
F | 2 | 粉末 | 15 | 5 |
(1)写出实验中发生反应的离子方程式:___________,该反应是_____反应(填“放热”或“吸热”);
(2)仔细观察A~F的实验数据对比,你可以得到关于温度影响反应速率结论,用此结论,计算:55℃时,2g锌薄片溶解于酸中需花____ s。
(3)对比结果B与F,解释结果F那么快的原因:________
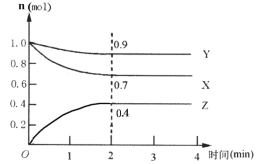
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0~4分钟各物质的量的变化情况如图所示(X、Y、Z均为气体)。
(1)该反应的的化学方程式为_______;
(2)反应开始至2分钟时,X的平均反应速率为______;
(3)能说明该反应已达到平衡状态的是______;
a.每消耗3molX,同时消耗1molY
b.容器内压强保持不变
c.Z的浓度不再变化
d.容器内混合气体的密度保持不变
(4)由下图求得平衡时Y的转化率为_____。
【题目】甲酸(HCOOH)是还原性酸,又称作蚁酸,常用于橡胶、医药、染料、皮革等工业生产。某化学兴趣小组在分析甲酸的组成和结构后,对甲酸的某些性质进行了探究。请回答下列问题。
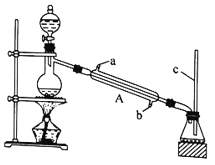
I.甲酸能与醇发生酯化反应
该兴趣小组用如上图所示装置进行甲酸(HCOOH)与甲醇(CH3OH)的酯化反应实验:
有关物质的性质如下:
沸点/℃ | 密度(g·cm-3) | 水中溶解性 | |
甲醇 | 64.5 | 0.79 | 易溶 |
甲酸 | 100.7 | 1.22 | 易溶 |
甲酸甲酯 | 31.5 | 0.98 | 易溶 |
(1)装置中,仪器A的名称是_________________,长玻璃管c的作用是__________________________。
(2)甲酸和甲醇进行酯化反应的化学方程式为____________________________________________。
(3)要从锥形瓶内所得的混合物中提取甲酸甲酯,可采用的方法为__________________________________。
II.甲酸能脱水制取一氧化碳

(1)利用上图装置制备并收集CO气体,其正确的连接顺序为a→__________(按气流方向从左到右,用小写字母表示)。
(2)装置B的作用是__________________________________。
(3)一定条件下,CO能与NaOH固体发生反应:CO+NaOH ![]() HCOONa。
HCOONa。
①为了证明“CO与NaOH固体发生了反应”,设计下列定性实验方案:取固体产物,配成溶液,___________。
②测定产物中甲酸钠(HCOONa)的纯度:准确称取固体产物8,0g配制成100mL溶液,量取20.00mL该溶液于锥形瓶中,再加入___________作指示剂,用1.5mol/L的盐酸标准溶液滴定剩余的NaOH,平行滴定三次,平均消耗盐酸的体积为5.05mL,则产物中甲酸钠的质量分数为_______(计算结果精确到0.1%)。