题目内容
4.将两支惰性电极插入500mL AgNO3溶液中,通电一段时间后,阴极上析出银的质量为0.54g(设阴极没有H2放出,且电解质溶液体积不变),试计算:(1)阳极放出氧气的体积(标况下);
(2)此时溶液的pH.
分析 当阴极上析出银的质量为0.54g,根据阴极反应Ag++e-=Ag,阳极反应为4OH--4e-=O2+2H2O,结合得失电子守恒进行计算.
解答 解:(1)当阴极上析出银的质量为0.54g,则根据阴极反应Ag++e-=Ag,所以转移电子数为$\frac{0.54g}{108g/mol}$=0.005mol,阳极反应为4OH--4e-=O2+2H2O,根据得失电子守恒则阳极放出氧气的体积为$\frac{0.005}{4}$×22.4=0.028L,答:阳极放出氧气的体积为0.028L;
(2)由阳极反应为4OH--4e-=O2+2H2O,则消耗氢氧根为0.005mol,所以溶液中的氢离子为0.005mol,浓度为$\frac{0.005mol}{0.5L}$=0.01mol/L,所以此时溶液的pH为2,答:此时溶液的pH为2.
点评 本题以电解原理为载体考查了氧化还原反应的有关计算,根据电极得失电子守恒的关系计算即可,难度不大.

练习册系列答案
相关题目
14.某链状有机物分子中含有m个-CH3,n个-CH2-,a个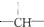 ,其余为-Cl,则-Cl的数目可能是( )
,其余为-Cl,则-Cl的数目可能是( )
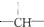 ,其余为-Cl,则-Cl的数目可能是( )
,其余为-Cl,则-Cl的数目可能是( )| A. | 2n+3a-m | B. | a+2-m | C. | n+m+a | D. | a+2n+2-m |
15.下列描述中,前者一定大于后者的( )
| A. | 22.4LCO2与11.2LCO气体所含的分子数 | |
| B. | 放热反应中,反应物的总能量与生成物的总能量 | |
| C. | 0.2mol/LNaOH与0.1mol/LNa2CO3溶液中Na+的物质的量浓度 | |
| D. | 1mol水分子与1mol铵根离子中含有的电子数 |
12.把金属A放入盐B(NO3)2的溶液中,发生如下反应:发生如下反应:A+B2+═A2++B,以下说法正确的是( )
| A. | 常温下金属A一定能与水反应,B一定不能与水反应 | |
| B. | A与B用导线连接后放入酒精中,一定形成原电池 | |
| C. | A与B用导线连接后放入B(NO3)2的溶液中,一定有电流产生 | |
| D. | 由A与B形成的原电池,A一定是负极,B一定是正极 |
9.设NA表示阿佛加德罗常数,下列说法正确的是( )
| A. | 0.1mol冰醋酸、0.1mol无水乙醇和浓硫酸混合加热后可得0.1NA个乙酸乙酯分子 | |
| B. | 0.1molL-1Na2SO4溶液中含2NA个Na+ | |
| C. | 2.7g的铝是足量的NaOH溶液充分反应,转移的电子数为0.3NA | |
| D. | 标准状况下,11.2升CCl4中所含的氯原子数目为2NA |
13.用NA表示阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 0.1mol Na2O2固体中阳离子与阴离子的总数为0.4NA | |
| B. | 46g NO2和N2O4的混合气体中含有的氧原子数为2NA | |
| C. | 1mol Fe与硫恰好完全反应时,转移电子数一定为3NA | |
| D. | 标准状况下,1mol CH4与过量的氯气发生取代反应,生成CH3Cl气体的体积约为22.4L |
8.用FeCl3溶液腐蚀印刷电路板上铜箔的反应是:2Fe3++Cu=2Fe2++Cu2+.下列有关说法正确的是( )
| A. | Cu是还原剂,被腐蚀 | B. | Fe2+是氧化产物 | ||
| C. | 该反应是置换反应 | D. | 该反应属于离子反应 |
 .
.