题目内容
19.如图1为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题: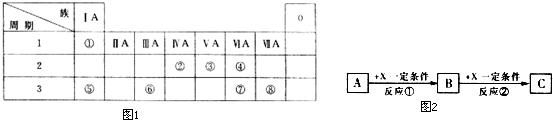
Ⅰ.(1)④和⑦中氢化物中较稳定的是H2O(填氢化物的化学式).
(2)①、④两种元素的原子按1:1组成的化合物的电子式为
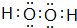 .
.(3)②、③、④的原子半径由小到大的顺序为O<N<C(用元素符号表示).
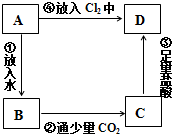
Ⅱ.由表中①~⑧中的一种或几种元素形成的常见物质A、B、C可发生图2反应(副产物已略去),试回答:
(1)若X是强氧性化单质,则A不可能是d(填序号).
a.S.b.N2 c.Na d.Al
(2)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,检验此C溶液中金属离子的方法是(写出操作和现象)先加入KSCN溶液不显红色,再加入氯水显红色(或加入氢氧化钠溶液,产生白色沉淀,然后变成灰绿色,最后变成红褐色).
(3)若A、B、C为含有同一金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,且B具有两性.写出A与C两溶液反应的离子方程式Al3++3AlO2-+6H2O=4Al(OH)3↓.
分析 由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为S、⑧为Cl.
Ⅰ.(1)元素非金属性越强,氢化物越稳定;
(2)①、④两种元素的原子按1:1组成的化合物为H2O2,分子中氧原子之间形成1对共用电子对,氧原子与氢原子之间形成1对共用电子对;
(3)同周期自左而右原子半径减小;
Ⅱ.(1)若X是强氧化性单质,由转化图可知,A物质能连续被氧化;
(2)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,由转化关系可知,则X为Fe,A为氯气、B为氯化铁、C为氯化亚铁;
(2)若A、B、C为含有同一金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,且B具有两性,则A为铝盐,B为氢氧化铝、C为偏铝酸钠,X为氢氧化钠.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为S、⑧为Cl.
Ⅰ.(1)非金属性O>S,元素非金属性越强,氢化物越稳定,故稳定性H2O>H2S,故答案为:H2O;
(2)①、④两种元素的原子按1:1组成的化合物为H2O2,分子中氧原子之间形成1对共用电子对,氧原子与氢原子之间形成1对共用电子对,电子式为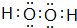 ,故答案为:
,故答案为: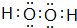 ;
;
(3)同周期自左而右原子半径减小,故原子半径:O<N<C,故答案为:O<N<C;
Ⅱ.(1)若X是强氧化性单质,由转化图可知,A物质能连续被氧化,选项中Al不能发生连续氧化反应,故答案为:d;
(2)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,由转化关系可知,则X为Fe,A为氯气、B为氯化铁、C为氯化亚铁,C溶液中金属离子为Fe2+,检验Fe2+离子的方法是:先加入KSCN溶液不显红色,再加入氯水显红色(或加入氢氧化钠溶液,产生白色沉淀,然后变成灰绿色,最后变成红褐色);
故答案为:先加入KSCN溶液不显红色,再加入氯水显红色(或加入氢氧化钠溶液,产生白色沉淀,然后变成灰绿色,最后变成红褐色);
(3)若A、B、C为含有同一金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,且B具有两性,则A为铝盐,B为氢氧化铝、C为偏铝酸钠,X为氢氧化钠,A与C两溶液反应的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓.
点评 本题考查无机物的推断及元素周期律、元素周期表,元素及物质的推断是解答本题的关键,注重对高考常考考点的考查,对学生能力要求较高,题目难度中等.

| A. | 汽油、柴油和植物油都是碳氢化合物 | |
| B. | 浓H2SO4具有吸水性,可用来干燥氨气 | |
| C. | 金属铝的生产是以Al2O3为原料,在熔融状态下进行电解 | |
| D. | 糖类、蛋白质、油脂属于天然高分子化合物 |
| A. | 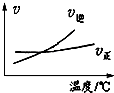 可判断可逆反应“A2(g)+3B2(g)?2AB3(g)”的△H>0 | |
| B. | 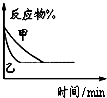 表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 | |
| C. | 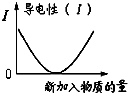 可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 | |
| D. | 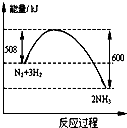 是N2与H2合成氨的能量变化曲线,可确定该反应1 mol N2和3 mol H2充分反应时放热一定小于92 kJ |
| 元素编号 | 元素性质或原子结构 |
| X | X+具有与Ne原子相同的电子层结构 |
| Y | 最外层电子数是次外层的一半,其最高正价与最低负价的绝对值相等 |
| Z | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| T | 元素单质的颜色是黄绿色的气体 |
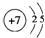 .
.(2)X元素与T元素形成化合物的电子式是
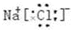 .
.(3)X的最高价氧化物对应水化物的化学式是NaOH,化学键类型有离子键、共价键.
(4)Y和Z的最高价氧化物对应的水化物中酸性较强的是HNO3(填化学式)写出可以验证该结论的一个简单易行的实验方案向Na2SiO3溶液中滴加HNO3溶液,产生白色沉淀.
| A. | ${\;}_{6}^{14}$C和${\;}_{7}^{14}$N质量数相同,属于同主族元素 | |
| B. | ${\;}_{3}^{6}$Li和${\;}_{3}^{7}$Li为同种元素的不同核素,互称同位素 | |
| C. | 表示6种核素 | |
| D. | ${\;}_{11}^{23}$Na和${\;}_{12}^{24}$Mg的中子数相同 |
| A. | 0 | B. | 1 | C. | 2 | D. | 3 |
| A. | M具有很高的熔沸点 | |
| B. | M容易汽化,可用作制冷材料 | |
| C. | M和干冰互为同素异形体 | |
| D. | M是由C原子和O原子按1:2的比例所组成的平面网状的晶体 |