题目内容
【题目】控制合适的条件,将反应2Fe3++2I-![]() 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )
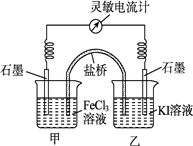
A. 反应开始时,甲中石墨电极上Fe3+被还原
B. 反应开始时,乙中石墨电极上发生氧化反应
C. 电流计读数为零时,反应达到化学平衡状态
D. 电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极;
【答案】D
【解析】分析:根据常温下能自动发生的氧化还原反应都可设计成原电池,再利用正反应2Fe3++2I-![]() 2Fe2++I2可知,铁元素的化合价降低,而碘元素的化合价升高,则图中甲烧杯中的石墨作正极,乙烧杯中的石墨作负极,利用负极发生氧化反应,正极发生还原反应,并利用平衡移动来分析解答。
2Fe2++I2可知,铁元素的化合价降低,而碘元素的化合价升高,则图中甲烧杯中的石墨作正极,乙烧杯中的石墨作负极,利用负极发生氧化反应,正极发生还原反应,并利用平衡移动来分析解答。
详解:A、由总反应方程式知,Fe3+被还原成Fe2+,则甲中石墨电极上Fe3+被还原,发生还原反应,A正确;
B、因乙中I-失去电子放电,元素的化合价升高,发生氧化反应,乙中石墨电极上发生氧化反应,电极反应式为:2I--2e-=I2,B正确;
C、当电流计为零时,说明没有电子发生转移,则反应达到平衡,C正确;
D、当加入Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,作为负极,而乙中石墨成为正极,D错误;答案选D。

【题目】在花瓶中加入“鲜花保鲜剂”可延长鲜花的寿命。下表是1 L“鲜花保鲜剂”的成分,阅读后并回答下列问题:
成分 | 质量/g | 摩尔质量/(g·mol-1) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
(1)“鲜花保鲜剂”中物质的量浓度最大的成分是__________(填写名称)。
(2)“鲜花保鲜剂”中K+的物质的量浓度为(阿司匹林中不含K+)__________________(只要求写表达式,不需计算)mol·L-1。
(3)下图所示的仪器中,在配制“鲜花保鲜剂”溶液时肯定不需要的是________(填字母),还缺少的玻璃仪器有__________________(填仪器名称)。
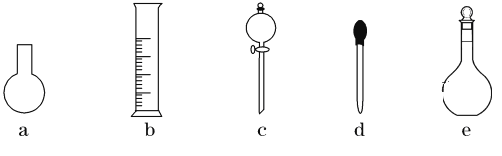
(4)配制过程中,下列操作对配制结果没有影响的是__________(填字母)。
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视液面
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(5)欲确定“鲜花保鲜剂”中硝酸银的浓度,可加入的试剂中要含有__________。(填化学符号)