题目内容
【题目】有MgCl2和Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的体积关系如图所示,则原溶液中MgCl2和Al2(SO4)3的物质的量浓度之比为( )
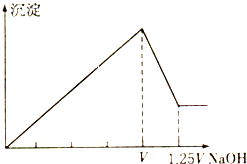
A. 1:2 B. 2:1 C. 1:1 D. 2:3
【答案】C
【解析】
MgCl2和Al2(SO4)3先与NaOH生成Mg(OH)2和Al(OH)3沉淀,沉淀最大时,再加NaOH,Al(OH)3溶于NaOH,沉淀减少,Al(OH)3溶解消耗0.25V的NaOH溶液,设NaOH浓度为c,根据方程式Al(OH)3+NaOH=NaAlO2+2H2O,Al(OH)3的物质的量为0.25Vc,又根据Al2(SO4)3+6Na OH=2Al(OH)3↓+3Na2SO4可知:Al2(SO4)3的物质的量为0.125Vc,消耗NaOH的量为0.125*6Vc =0.75Vc,MgCl2和Al2(SO4)3总共消耗NaOH 的物质的量Vc,MgCl2消耗NaOH的量为Vc-0.75Vc=0.25Vc,根据MgCl2+2NaOH=Mg(OH)2↓+2NaCl知MgCl2的物质的量为0.25Vc/2=0.125Vc ,则原溶液中MgCl2和Al2(SO4)3的物质的量浓度之比为0.125Vc/0.125Vc =1:1,C正确,正确答案为C

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目