题目内容
【题目】铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与11.2 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。则消耗铜的质量为
A. 32 g B. 48 g C. 64 g D. 96 g
【答案】C
【解析】
铜与一定量浓硝酸反应,得到硝酸铜溶液和NO、N2O4、NO2的混合气体,这些气体与11.2LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,完全生成HNO3,则整个过程中HNO3反应前后没有变化,说明铜失去的电子给做氧化剂的硝酸,生成气体,气体和氧气全部反应生成硝酸,证明氧气得到的电子和铜失去的电子相同,即Cu失去的电子都被O2得到,由电子守恒可知n(Cu)×2=n(O2)×4,n(Cu)=![]() =1mol,m(Cu)=1mol×64g/mol=64g,故C正确;
=1mol,m(Cu)=1mol×64g/mol=64g,故C正确;
正确答案:C。

练习册系列答案
相关题目
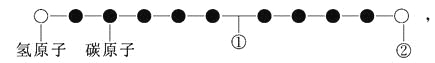
【题目】用右图所示装置进行下列实验,实验结果与预测的现象不一致的是

①中的物质 | ②中的物质 | 预测①中现象 | |
A | 淀粉碘化钾溶液 | 浓硝酸 | 无明显现象 |
B | 酚酞溶液 | 浓盐酸 | 无明显现象 |
C | 氯化铝溶液 | 浓氨水 | 有白色沉淀 |
D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
A. A B. B C. C D. D