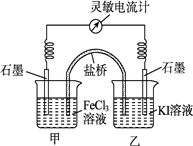
题目内容
【题目】知在稀硫酸中,KBrO3和KI能发生以下反应(均未配平):BrO3—+H++I—![]() IO3—+Br2+H2O IO3—+H++ Br—
IO3—+Br2+H2O IO3—+H++ Br—![]() Br2+I2+H2O
Br2+I2+H2O
(1)试比较在酸性条件下BrO3—、Br2、IO3—、I2氧化性的强弱:_____>_____>_____>_____。
(2)配平下列反应的离子方程式:_____BrO3—+_____H++_____I—![]() _____I2+ _____Br—+_____H2O,反应中的氧化剂是_____________;被氧化的元素是______________。
_____I2+ _____Br—+_____H2O,反应中的氧化剂是_____________;被氧化的元素是______________。
(3)以下离子方程式错误的是______________(选填答案编号)。
a.6I-+ BrO3-+ 6H + → 3I2 + Br-+ 3H2O
b.IO3-+ Br-→I-+ BrO3-
c.5I-+ 6BrO3-+ 6H + →3 Br2+ 5 IO3-+ 3H2O
d.5I-+ 2BrO3-+ 6H + → Br2 + IO3-+ 2I2 + 3H2O
【答案】BrO3-IO3-Br2I2166313BrO3-碘b
【解析】
1)在反应BrO3—+H++I—![]() IO3—+Br2+H2O 中,氧化性: BrO3—>IO3—,在反应IO3—+H++ Br—
IO3—+Br2+H2O 中,氧化性: BrO3—>IO3—,在反应IO3—+H++ Br—![]() Br2+I2+H2O 中,氧化性: IO3—>Br2,又氧化性: Br2>I2,则氧化性: BrO3->IO3->Br2 >I2;
Br2+I2+H2O 中,氧化性: IO3—>Br2,又氧化性: Br2>I2,则氧化性: BrO3->IO3->Br2 >I2;
(2)反应中BrO3—化合价由+5价降为-1价, I—化合价由-1价升高为0价,二者在反应中得失电子数目相等,则有二者的计量数比值为1:6,根据离子方程式电荷守恒,可配平衡方程式为BrO3—+6H++6I—=3I2+ Br—+3H2O ,其中氧化剂为BrO3—, 被氧化的元素是碘元素;
(3)因为氧化性BrO3->IO3-,所以IO3-+ Br-→I-+ BrO3-不符合氧化还原反应的规律,故b错误。