题目内容
5.目前,汽车尾气已成为许多大城市空气的主要污染源,汽车尾气中含有CO、NO等多种污染物.(1)汽车燃料中一般不含氮元素,尾气中所含的NO是如何产生的?说明原因并写出有关反应的方程式在放电时空气中的N2和O2反应NO,N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO.
(2)NO对大气的影响之一是导致酸雨,用化学方程式表示NO形成酸雨的原因是2NO+O2═2NO2、3NO2+H2O═2HNO3+NO.
(3)将CaCO3粉末喷洒到湖泊中,可消除酸雨对水质的影响,反应的离子方程式是CaCO3+2H+═Ca2++CO2↑+H2O.
分析 (1)空气中的氮气在放电或高温下反应生成NO;
(2)NO与空气的主要成份氧气反应生成二氧化氮,二氧化氮与水反应生成硝酸和一氧化氮;
(3)CaCO3粉末与酸反应生成氯化钙、水和二氧化碳来消除酸雨对水质的影响.
解答 解:(1)空气中的氮气在放电或高温下反应生成NO,该反应为N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,故答案为:在放电时空气中的N2和O2反应NO,N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO;
(2)NO与空气的主要成份氧气反应生成二氧化氮,反应方程式为:2NO+O2═2NO2,二氧化氮与水反应生成硝酸和一氧化氮,反应方程式为:3NO2+H2O═2HNO3+NO,所以NO对大气的影响之一是导致酸雨,故答案为:2NO+O2═2NO2、3NO2+H2O═2HNO3+NO;
(3)CaCO3粉末与酸反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O,故答案为:CaCO3+2H+═Ca2++CO2↑+H2O.
点评 本题考查了酸雨的成因、性质和治理等,难度不大,注意积累.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
15.以下能级符号正确的是( )
| A. | 5s | B. | 2d | C. | 3 f | D. | 1p |
20.X、Y、Z、W、T是原子序数依次增大的前四个周期的元素,其中有两种是常见金属元素.其相关信息如表:
(1)X、Y、Z三种元素的电负性由大到小的顺序是O>C>Al(用元素符号表示,下同);在H-X、H-Y两种共价键中,键的极性较大的是H-O.
(2)T2+的电子排布式为1s22s22p63s23p63d6;T的单质在高温下与Y的氢化物反应,其化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;工业上用W的氧化物与X的单质高温下反应制得W单质的粗产品,其化学反应方程式为SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(3)两种氢化物X2H2和H2Y2中沸点较高的是H2O2,两者沸点相差很大的原因是H2O2分子之间存在氢键,而C2H2分子之间为范德华力.
(4)在25℃、101kPa下,已知W稳定的气态氢化物在Y的气态单质中完全燃烧,恢复至原来状态,平均每消耗4gW稳定的气态氢化物放热190.0KJ,则该反应的热化学方程式SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520kJ/mol.
| 元素 | 相关信息 |
| X | X一种核素在考古时常用来坚定一些文物的年代 |
| Y | Y基态原子的s轨道电子与P轨道电子数相等 |
| Z | Z是所在周期的单核离子中半径最小 |
| W | W的单质被誉为“信息革命的催化剂”常用做半导体材料 |
| T | T有多种氧化物,其中一种纯净的氧化物可用来作录音磁带和 电讯器材的原材料 |
(2)T2+的电子排布式为1s22s22p63s23p63d6;T的单质在高温下与Y的氢化物反应,其化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;工业上用W的氧化物与X的单质高温下反应制得W单质的粗产品,其化学反应方程式为SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(3)两种氢化物X2H2和H2Y2中沸点较高的是H2O2,两者沸点相差很大的原因是H2O2分子之间存在氢键,而C2H2分子之间为范德华力.
(4)在25℃、101kPa下,已知W稳定的气态氢化物在Y的气态单质中完全燃烧,恢复至原来状态,平均每消耗4gW稳定的气态氢化物放热190.0KJ,则该反应的热化学方程式SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520kJ/mol.
17.按系统命名法命名时,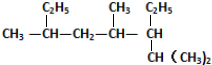 的主链碳原子数是( )
的主链碳原子数是( )
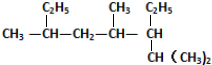 的主链碳原子数是( )
的主链碳原子数是( )| A. | 5 | B. | 6 | C. | 7 | D. | 8 |
12.在海水的综合利用中,海水提溴工业是一个重要组成部分,其中一种提溴的工艺是在预先浓缩并酸化的海水中,通入足量氯气,然后使生成的溴与吸收剂SO2 反应转化为氢溴酸以达到富集溴元素的目的.在有关上述工艺流程的以下化学用语中,错误的是( )
| A. | 用电子式表示氢溴酸的形成过程为: | |
| B. | 海水中Br-的电子式为: | |
| C. | 海水中通入氯气时发生反应的离子方程式为:2Br-+Cl2=Br2+2Cl- | |
| D. | Cl-的结构示意图为: |
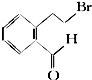 下面的框图是应用2-(2-溴乙基)苯甲醛为原料合成有机化合物C和F的流程图:
下面的框图是应用2-(2-溴乙基)苯甲醛为原料合成有机化合物C和F的流程图: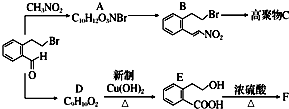
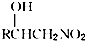
 .
.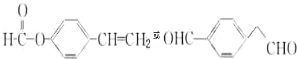 .
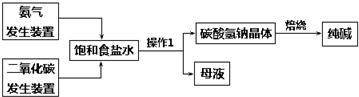
.
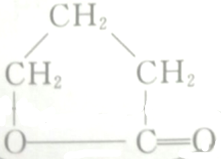 的各步反应方程式:
的各步反应方程式: