题目内容
13.常温下,Cu(OH)2悬浊液中存在平衡:Cu(OH)2(s)?Cu2+(aq)+2OH-(aq),Ksp[(Cu(OH)2]=2.0×10-20.下列说法中正确的是( )| A. | 向Cu(OH)2悬浊液中加入少量CuSO4粉末,平衡向左移动,溶液中离子的总浓度会减小 | |
| B. | 当溶液中c(Cu2+)•c2(OH-)=2.0×10-20时,此溶液一定为Cu(OH)2的饱和溶液 | |
| C. | 若使0.02 mol•L-1的CuSO4溶液中生成Cu(OH)2沉淀,应调整溶液的pH≥5 | |
| D. | 向Cu(OH)2悬浊液中加入Na2S溶液,蓝色沉淀变成黑色,证明此条件下K甲(CuS)>K甲[Cu(OH)2] |
分析 A、溶液中含有Cu2+离子,离子的总浓度增大;
B、当溶液中c(Cu2+)•c2(OH-)=2.0×10-20=Ksp[(Cu(OH)2],此时溶液达到饱和;
C、在常温下如果要生成Cu(OH)2沉淀,则c(Cu2+)×c2(OH-)≥2×10-20,所以c(OH-)≥$\sqrt{\frac{2×1{0}^{-20}}{0.02}}$=10-9(mol/L),应调节溶液pH大于5;
D、沉淀向溶解度更小的转化.
解答 解:A、往其中加入少量CuSO4粉末,平衡向左移动,溶液中含有Cu2+离子,离子的总浓度增大,故A错误;
B、当溶液中c(Cu2+)•c2(OH-)=2.0×10-20=Ksp[(Cu(OH)2],此时溶液达到饱和,故B正确;
C、已知Ksp=2×10-20,c(Cu2+)=0.02mol•L-1,在常温下如果要生成Cu(OH)2沉淀,则c(Cu2+)×c2(OH-)≥2×10-20,所以c(OH-)≥$\sqrt{\frac{2×1{0}^{-20}}{0.02}}$=10-9(mol/L),应调节溶液pH大于5,故C错误;
D、沉淀向溶解度更小的转化,蓝色沉淀变成黑色,此条件下K甲(CuS)<K甲[Cu(OH)2],故D错误;
故选B.
点评 本题考查难溶电解质的溶解平衡,侧重于浓度的计算,题目难度不大,注意把握计算公式的运用.

练习册系列答案
相关题目
12.某饱和一元醇 8g 与足量金属钠反应产生氢气 2.8L(标准状况).该醇可能是( )
| A. | 甲醇 | B. | 乙醇 | C. | 丙醇 | D. | 丁醇 |
4.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA | |
| B. | 常温常压下,3.0g含甲醛(HCHO)的冰醋酸中含有的原子总数为0.4NA | |
| C. | 标准状况下,2.24L的苯中含有的σ键数为1.2NA | |
| D. | 将CO2通过Na2O2使其增重a克时,反应中转移电子数为$\frac{a{N}_{A}}{14}$ |
1.下列各组有机物中,无论以何种比例混合,只要二者物质的量之和不变,完全燃烧时消耗O2的物质的量和生成H2O的物质的量保持不变的是( )
| A. | 乙烯、丙烯酸(CH2=CH-COOH) | B. | 乙酸、甲醛(HCHO) | ||
| C. | 甲烷、乙二醇(HOCH2CH2OH) | D. | 乙烷、乙醇 |
18.在一定温度下,一定量的水中,Mg(OH)2悬浊液里有如下平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),当向混合物中加入少量粉末状MgO时,下列说法正确的是( )
| A. | Mg2+的数目减少 | B. | Mg2+的浓度增大 | ||
| C. | 溶液pH不变 | D. | Mg(OH)2固体质量不变 |
2.关于含正离子N5+的化合物N5AsF6,下列叙述中错误的是( )
| A. | N5+共有34个核外电子 | B. | N5+中氮原子间以离子键结合 | ||
| C. | 化合物N5AsF6中AS的化合价为+5价 | D. | 化合物N5AsF6为离子化合物 |
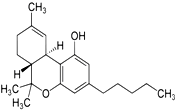 2014年国际禁毒日的主题是“珍惜美好青春,远离合成毒品、拒绝毒品、健康人生”.如图是大麻的主要成分THC的结构式.下列关于THC的说法中正确的是BEF
2014年国际禁毒日的主题是“珍惜美好青春,远离合成毒品、拒绝毒品、健康人生”.如图是大麻的主要成分THC的结构式.下列关于THC的说法中正确的是BEF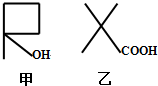 “有钱就是这么任性”是2014年最新流行起来的网络用语.用来调侃有钱人令网友大跌眼镜的做事风格.甲、乙两种有机物分子的键线式如图,很像“任性”的汉语拼音缩写.
“有钱就是这么任性”是2014年最新流行起来的网络用语.用来调侃有钱人令网友大跌眼镜的做事风格.甲、乙两种有机物分子的键线式如图,很像“任性”的汉语拼音缩写.