题目内容
5.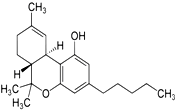 2014年国际禁毒日的主题是“珍惜美好青春,远离合成毒品、拒绝毒品、健康人生”.如图是大麻的主要成分THC的结构式.下列关于THC的说法中正确的是BEF
2014年国际禁毒日的主题是“珍惜美好青春,远离合成毒品、拒绝毒品、健康人生”.如图是大麻的主要成分THC的结构式.下列关于THC的说法中正确的是BEFA.分子中含有苯环,属于芳香烃类化合物
B.难溶于水,易溶于乙醇、乙醚、苯和碱溶液
C.可以发生加成反应、取代反应、氧化反应、消去反应
D.除氢原子外,分子中所有的其它原子都在一个平面上
E.遇FeCl3溶液显紫色;可以使溴的四氯化碳溶液褪色
F.通常状态下,1mol该物质最多可与3mol Br2发生反应.
分析 有机物含有碳碳双键、酚羟基、醚键,结合烯烃、苯酚的性质以及有机物的空间结构以及相关概念解答该题.
解答 解:A.分子中含有苯环,含有的元素种类有碳、氢、氧,属于芳香族类化合物,不属于烃类,故A错误;
B.此分子中含有的碳原子数比较多,故难溶于水,与有机物是可以互溶的,此有机物中含有酚羟基,能与碱反应,故可以溶于碱溶液中,故B正确;
C.羟基连接在苯环上,不能发生消去反应,故C错误;
D.此分子结构中含有烷基碳,故分子中碳原子不可能都在一个平面上,故D错误;
E.此分子中含有酚羟基,遇FeCl3溶液显紫色;此分子中含有碳碳双键,可以与溴单质发生加成反应,使溴的四氯化碳溶液褪色,故E正确;
F.与溴单质反应的官能团有碳碳双键和酚羟基,通常状态下,1mol该物质最多可与3mol Br2发生反应,故F正确;
故答案为:BEF.
点评 本题考查有机物的结构和性质,解答该题要注意把握官能团的性质,准确理解烃的定义,仔细分析有机物的结构简式,题目难度不大.

练习册系列答案
相关题目
16.下列说法正确的是( )
| A. | 原子的最外层电子数相同的元素,一定属于同一族 | |
| B. | 电子层数相同的粒子,对应元素一定属于同一周期 | |
| C. | 元素周期表中元素排序的依据是原子的核电荷数 | |
| D. | 元素周期表中有十六个纵行,也就是十六个族 |
13.常温下,Cu(OH)2悬浊液中存在平衡:Cu(OH)2(s)?Cu2+(aq)+2OH-(aq),Ksp[(Cu(OH)2]=2.0×10-20.下列说法中正确的是( )
| A. | 向Cu(OH)2悬浊液中加入少量CuSO4粉末,平衡向左移动,溶液中离子的总浓度会减小 | |
| B. | 当溶液中c(Cu2+)•c2(OH-)=2.0×10-20时,此溶液一定为Cu(OH)2的饱和溶液 | |
| C. | 若使0.02 mol•L-1的CuSO4溶液中生成Cu(OH)2沉淀,应调整溶液的pH≥5 | |
| D. | 向Cu(OH)2悬浊液中加入Na2S溶液,蓝色沉淀变成黑色,证明此条件下K甲(CuS)>K甲[Cu(OH)2] |
20.某自来水中含有Ca2+、Mg2+、Na+、K+、HCO3-、SO42-、Cl-,长期烧煮上述自来水会在锅炉内形成水垢,锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢,已知部分物质20℃时的溶解度数据有:
(1)请用化学方程式表示锅炉中的水垢含有Mg(OH)2的原因:Mg(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3↓+H2O+CO2↑、MgCO3+H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+CO2↑.
(2)锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X使其转化为易溶于盐酸的物质Y而除去,试剂X是C(填序号).
A.食醋 B.氯化钡 C.碳酸钠 D.碳酸氢钠
CaSO4能转化为物质Y的原因是(用文字叙述)碳酸钙的溶解度小于硫酸钙的溶解度.
(3)除含CaSO4、Mg(OH)2外,锅炉水垢中还可能含有的物质是(写化学式)CaCO3、MgCO3等.
(4)水中的Ca2+、Mg2+可以用一定浓度的M溶液进行测定,M与Ca2+、Mg2+都以等物质的量进行反应,现取含Ca2+浓度为0.40g/L的自来水样10mL至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01mol/L的M溶液20.00mL,则该自来水样中Mg2+的物质的量浓度是0.01 mol/L.
| 物质 | Mg(OH)2 | CaCO3 | MgCO3 | Ca(OH)2 | CaSO4 | MgSO4 |
| 溶解度(g/100g H2O) | 9.0×10-4 | 1.5×10-3 | 1.0×10-2 | 1.7×10-1 | 2.0×10-1 | 26.7 |
(2)锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X使其转化为易溶于盐酸的物质Y而除去,试剂X是C(填序号).
A.食醋 B.氯化钡 C.碳酸钠 D.碳酸氢钠
CaSO4能转化为物质Y的原因是(用文字叙述)碳酸钙的溶解度小于硫酸钙的溶解度.
(3)除含CaSO4、Mg(OH)2外,锅炉水垢中还可能含有的物质是(写化学式)CaCO3、MgCO3等.
(4)水中的Ca2+、Mg2+可以用一定浓度的M溶液进行测定,M与Ca2+、Mg2+都以等物质的量进行反应,现取含Ca2+浓度为0.40g/L的自来水样10mL至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01mol/L的M溶液20.00mL,则该自来水样中Mg2+的物质的量浓度是0.01 mol/L.
10.电解硫酸铜溶液一段时间后,停止电解.往溶液中加入1mol Cu(OH)2和3mol水,可以使溶液恢复到电解前的成分和浓度,则在电解过程中,电子转移( )mol.
| A. | 10 | B. | 6 | ||
| C. | 2 | D. | 不可能出现此情况 |
17.下列描述,其因果关系成立的是( )
| A. | 因为酸性HF>HCl,所以非金属性F>Cl | |
| B. | 因为SO2、Cl2都有漂白性,所以二者混合使用漂白有色物质,效果会更好 | |
| C. | 因为某物质的焰色反应呈黄色,所以其一定是含Na元素的化合物 | |
| D. | 因为烯烃的通式为CnH2n,不同烯烃的实验式相同,所以烯烃的含碳量为一常数 |
14.0.1mol/L NH4Cl溶液中,由于NH4+的水解,使得c (NH4+)<0.1mol/L.如果要使c (NH4+)更接近于0.1mol/L,可采取的措施是( )
| A. | 加入少量氢氧化钠 | B. | 加入少量盐酸 | ||
| C. | 加入少量水 | D. | 加热 |
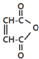 是一种有机试剂和有机合成原料,是丁烯二酸的酸酐.欲由1,3-丁二烯为原料制取丁烯二酸(HOOCCH=CHCOOH),设计如下四种路径:
是一种有机试剂和有机合成原料,是丁烯二酸的酸酐.欲由1,3-丁二烯为原料制取丁烯二酸(HOOCCH=CHCOOH),设计如下四种路径: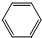 而不是
而不是 ,即假定苯仍具有普通烯烃的性质,则一分子该“环己三烯”在催化剂作用下与一分子H2发生加成反应后产物分子的结构简式是
,即假定苯仍具有普通烯烃的性质,则一分子该“环己三烯”在催化剂作用下与一分子H2发生加成反应后产物分子的结构简式是 或
或 .
.