题目内容
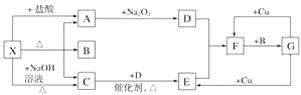
【题目】“翠矾”(NiSO4·7H2O)在印染工业作媒染剂,生产酞菁艳蓝络合剂;氟镍化钾(K2NiF4)是结构化学研究的热点物质。以镍废渣(主要成分为Ni,含少量Fe、Al、Fe3O4、Al2O3和不溶性杂质等)为原料合成“翠矾”和氟镍化钾的流程如下:
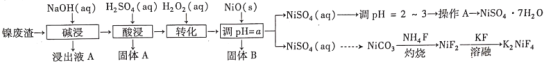
几种金属离子的氢氧化物沉淀pH如下:
请回答下列问题:
(1)翠矾、绿矾、明矾、蓝矾等“矾类”都含有______元素(填元素符号)。pH=a的范围为___________。
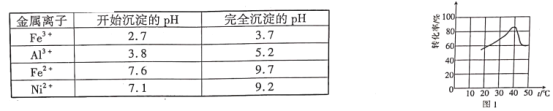
(2)“转化”过程中一定体积和浓度的双氧水,“转化率”与温度关系如图1所示。温度高于40℃,转化率急速降低的原因可能是______。空气可以替代双氧水,空气的作用是______(用离子方程式表示)。
(3)NiSO4和NH4HCO3溶液生成NiCO3,其离子方程式为___________。
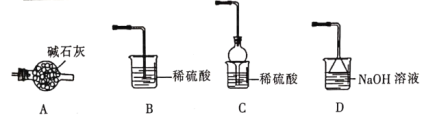
(4)灼烧NiCO3和NH4F以物质的量之比为1:1组成的混合物时,为避免污染环境,选择下列装置吸收尾气,最宜选择___________。(填选项)
(5)已知常温下,Ksp(NiCO3)=1.42×10-7。分离NiCO3时滤液中c(Ni2+)≤1.0×10-5 mol·L-1时,c(CO![]() )≥___________mol·L-1。
)≥___________mol·L-1。
(6)准确称取ω g翠矾晶体产品于锥形瓶中,加入足量的蒸馏水溶解配成250 mL溶液,取20.00 mL所配溶液于锥形瓶,用c mol·L-1的标准溶液EDTA(Na2H2Y)滴定至终点(发生Ni2++H2Y2-=NiY2-+2H+),三次实验消耗标准液的体积分别为20.02 mL、19.98 mL、19.50 mL,则翠矾的纯度为___________%(只列计算式,不考虑杂质反应)。
【答案】S、O、H 3.7≤a<7.1 温度过高,双氧水分解速率加快 4Fe2++O2+4H+=4Fe3++2H2O Ni2++2HCO3-=NiCO3↓+CO2↑+H2O C 1.42×10-2 ![]()
【解析】
先用NaOH溶液溶解镍废渣,除去可溶于NaOH的Al和Al2O3,过滤后的滤渣再用稀硫酸溶解,过滤除去不溶于酸的不溶性杂质固体,滤液中含有Fe2+、Ni2+和Fe3+,加入双氧水将溶液中的Fe2+完全氧化为Fe3+,再加入NiO调节溶液pH,使Fe3+完全沉淀为Fe(OH)3,过滤后所得NiSO4溶液,调节pH=2后,蒸发浓缩并冷却结晶、过滤、洗涤后得到NiSO4·7H2O;或在NiSO4溶液中加入NH4HCO3,获得NiCO3沉淀,并灼烧NiCO3和NH4F以物质的量之比为1:1组成的混合物获得NiF3,最后与KF一起加热熔融即可得到K2NiF4。
(1)绿矾成分为FeSO4·7H2O,蓝矾成分为CuSO4·5H2O,明矾成分是KAl(SO4)2·12H2O等,都含硫、氧、氢元素。观察表格数据和流程图,调节溶液pH的目的是除去Fe3+,使Fe3+完全沉淀,不使Ni2+沉淀,即3.7≤a<7.1;
(2)双氧水既能氧化Fe2+,同时双氧水也可能会分解,当温度低于40℃时氧化Fe2+为主,高于40℃时自身分解为主,导致氧化Fe2+的双氧水浓度降低,反应减慢,Fe2+转化率降低;空气中O2在酸性条件下氧化Fe2+生成Fe3+,发生反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O;
(3)HCO3-在水中存在电离和水解,NiCO3溶解度小,促进HCO3-电离为主,生成的氢离子与HCO3-反应生成CO2和H2O,反应过程为Ni2++2HCO3-=NiCO3↓+CO2↑+H2O;
(4)碳酸镍和氟化铵共热生成NiF2和NH3、CO2、H2O,尾气中NH3污染环境,而吸收氨气又要防倒吸,氨气的水溶液显碱性,碱石灰可以干燥氨气,不能吸收氨气,则应选择硫酸溶液吸收氨气,而不选择NaOH溶液吸收,故选择C装置吸收;
(5)根据溶度积计算,c(CO32-)=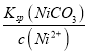 =
=![]() mol/L=1.42×10-2mol/L;
mol/L=1.42×10-2mol/L;
(6)NiSO4·7H2O的摩尔质量为281g/mol,舍去误差明显偏大的数据19.50mL,消耗EDTA溶液平均体积为20.00mL,产品的纯度为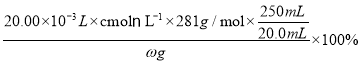 =
=![]() %。
%。

 备战中考寒假系列答案
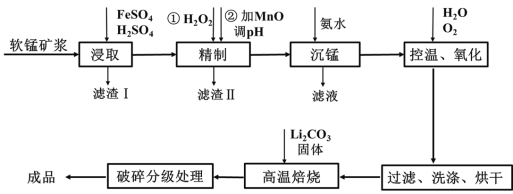
备战中考寒假系列答案【题目】新型锂电池正极材料锰酸锂(LiMn2O4)有望取代广泛使用的LiCoO2。工业上用某软锰矿(主要成分为MnO2,还含有少量铁、铝及硅等氧化物)为原料制备锰酸锂的流程如图:
已知: lg2=0.3,![]() =8,25℃有关物质的溶度积常数:
=8,25℃有关物质的溶度积常数:
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
Ksp | 8.0×10-16 | 4.0×l0-38 | 5.12×10-33 | 4.0×l0-14 |
(1)已知锂电池放电时正极的电极反应式为:LiMn2O4+e-+Li+ ===Li2Mn2O4,则锰酸锂中锰元素的化合价为____。
(2)“浸取”得到的浸取液中阳离子主要是Mn2+,生成Mn2+的离子方程式为_____,检验还含有Fe2+的方法是______。
(3)“精制”中加入H2O2的量比理论值大的多,其主要原因是______,若所得溶液中锰离子的浓度为1 mol·L-1,则加入氧化锰调节pH的范围为____(当溶液中离子浓度小于10-5 mol·L-1时可以认为沉淀完全)。
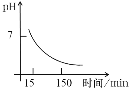
(4)“沉锰”得到的是Mn(OH)2和Mn2(OH)2SO4滤饼,二者均可被氧化为Mn3O4,若控温氧化时溶液的pH随时间的变化如下图,则15~150 min内滤饼中一定参加反应的成分是______;判断的理由是____(用化学方程式表示)。
(5)写出高温煅烧生成锰酸锂的化学方程式_______。
【题目】某学习小组用下列装置完成了探究浓硫酸和 SO2性质的实验(部分夹持装置已省略),下列“ 现象预测” 与“ 解释或结论” 均正确的是
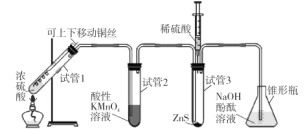
选项 | 仪器 | 现象预测 | 解释或结论 |
A | 试管1 | 有气泡、酸雾,溶液中有白色固体出现 | 酸雾是SO2所形成,白色固体是硫酸铜晶体 |
B | 试管2 | 紫红色溶液由深变浅,直至褪色 | SO2具有还原性 |
C | 试管3 | 注入稀硫酸后,没有现象 | 由于Ksp(ZnS)太小,SO2与ZnS在注入稀硫酸后仍不反应 |
D | 锥形瓶 | 溶液红色变浅 | NaOH溶液完全转化为NaHSO3溶液,NaHSO3溶液碱性小于NaOH |
A.AB.BC.CD.D