题目内容
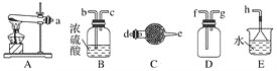
【题目】蓝矾(CuSO4·5H2O)常作杀菌剂。某小组设计如图1装置制备蓝矾,实验原理: Cu+CuCl2=2CuCl,4CuCl+O2+2H2O=2[Cu(OH)2·CuCl2],[Cu(OH)2·CuCl2]+H2SO4=CuSO4+CuCl2+2H2O。
操作步骤:向三颈瓶加入3.2 g Cu粉和适量稀硫酸及30 mL 1 mol·L-1 CuCl2溶液,利用二连球向三颈瓶中鼓入空气,铜溶解。当三颈烧瓶中呈乳状浑浊液时,滴加浓硫酸,得到蓝矾(不考虑氯化铜转化成硫酸铜)。下列说法正确的是

A.盛装CuCl2溶液的仪器是长颈漏斗B.在实验过程中,浓硫酸作氧化剂
C.采用重结晶法提纯CuSO4·5H2OD.理论上可以制备20 g CuSO4·5H2O
【答案】C
【解析】
A.盛装CuCl2溶液的仪器是分液漏斗,故A错误;
B.反应中氧化剂是O2,滴加浓硫酸增大反应物的浓度,并提供能量等,不作氧化剂,故B错误;
C.氯化铜的溶解度在常温下比硫酸铜晶体大得多,且氯化铜的溶解度随温度的变化程度不大,则选择重结晶法提纯CuSO4·5H2O,故C正确;
D.3.2 g Cu的物质的量为![]() =0.05mol,由实验原理可知,CuCl2起催化作用,则由原子守恒得理论生成的CuSO4·5H2O为0.05mol,质量为0.05mol×250g/mol=12.5g,故D错误;
=0.05mol,由实验原理可知,CuCl2起催化作用,则由原子守恒得理论生成的CuSO4·5H2O为0.05mol,质量为0.05mol×250g/mol=12.5g,故D错误;
故答案为C。

练习册系列答案
相关题目