题目内容
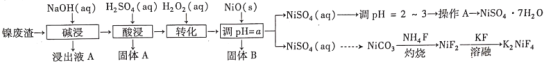
【题目】新型锂电池正极材料锰酸锂(LiMn2O4)有望取代广泛使用的LiCoO2。工业上用某软锰矿(主要成分为MnO2,还含有少量铁、铝及硅等氧化物)为原料制备锰酸锂的流程如图:
已知: lg2=0.3,![]() =8,25℃有关物质的溶度积常数:
=8,25℃有关物质的溶度积常数:
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
Ksp | 8.0×10-16 | 4.0×l0-38 | 5.12×10-33 | 4.0×l0-14 |
(1)已知锂电池放电时正极的电极反应式为:LiMn2O4+e-+Li+ ===Li2Mn2O4,则锰酸锂中锰元素的化合价为____。
(2)“浸取”得到的浸取液中阳离子主要是Mn2+,生成Mn2+的离子方程式为_____,检验还含有Fe2+的方法是______。
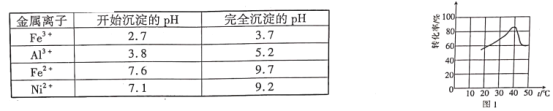
(3)“精制”中加入H2O2的量比理论值大的多,其主要原因是______,若所得溶液中锰离子的浓度为1 mol·L-1,则加入氧化锰调节pH的范围为____(当溶液中离子浓度小于10-5 mol·L-1时可以认为沉淀完全)。
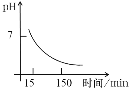
(4)“沉锰”得到的是Mn(OH)2和Mn2(OH)2SO4滤饼,二者均可被氧化为Mn3O4,若控温氧化时溶液的pH随时间的变化如下图,则15~150 min内滤饼中一定参加反应的成分是______;判断的理由是____(用化学方程式表示)。
(5)写出高温煅烧生成锰酸锂的化学方程式_______。
【答案】+3、+4 MnO2+2Fe2++4H+===Mn2++2Fe3++2H2O 取浸取液少许,加入几滴K3[Fe(CN)6]溶液(或酸性KMnO4溶液),若有蓝色沉淀生成(或紫红色褪去),则有Fe2+ 溶液中的铁离子催化过氧化氢分解 4.9-7.3 Mn2(OH)2SO4 3 Mn2(OH)2SO4+O2===2Mn3O4+3H2SO4 8Mn3O4 +6Li2CO3 +5O2![]() 6CO2 + 12LiMn2O4
6CO2 + 12LiMn2O4
【解析】
(2)用K3[Fe(CN)6] 溶液来检验Fe2+:
(3)“浸取”过程还剩余Fe3+,溶液中的铁离子催化过氧化氢分解;氢氧化铝完全沉淀时,铝离子浓度为10-5 mol·L-1,用Al(OH)3的Ksp计算氢氧根浓度,从而得到氢离子浓度,算得调节溶液最小的pH,锰离子的浓度为1 mol·L-1,用Mn(OH)2的Ksp计算氢氧根浓度,从而得到氢离子浓度,算得调节溶液最大的pH;
(4)将MnSO4溶液于氨水混合得到含有Mn(OH)2、Mn2(OH)2SO4的滤饼,将滤饼洗涤后加入蒸馏水并通入氧气,可能发生反应6Mn(OH)2+O2=2Mn3O4+6H2O、3Mn2(OH)2SO4+O2=2Mn3O4+3H2SO4;
(1) Li2Mn2O4中锰元素+3价,则LiMn2O4中锰元素有+4价,但只有一个锰原子得电子,另一个锰原子未得电子变价,也为+4价,则锂电池正极材料锰酸锂中,锰元素的化合价为+3、+4;故答案为:+3、+4;
(2) “浸取”过程MnO2转化为Mn2+,Mn元素从+4价降至+2价,离子方程式为:MnO2+2Fe2++4H+===Mn2++2Fe3++2H2O;可用K3[Fe(CN)6] 溶液来检验Fe2+:取浸取液少许,加入几滴K3[Fe(CN)6]溶液(或酸性KMnO4溶液),若有蓝色沉淀生成(或紫红色褪去),则有Fe2+;
(3) “浸取”过程还剩余Fe3+,“精制”中加入H2O2消耗一部分,故过氧化氢的量比理论值大的多,故答案为:溶液中的铁离子催化过氧化氢分解;除去Fe3+、Al3+,氢氧化铝完全沉淀时,![]() ,解得
,解得![]() ,
,![]() ,pH=4.9,锰离子的浓度为1 mol·L-1时,
,pH=4.9,锰离子的浓度为1 mol·L-1时,![]() ,
,![]() ,
,![]() ,pH=7.3,调节pH的范围为4.9-7.3;
,pH=7.3,调节pH的范围为4.9-7.3;
(4) 根据分析,滤饼含有Mn(OH)2、Mn2(OH)2SO4,与氧气可能的反应分别为6Mn(OH)2+O2=2Mn3O4+6H2O、3Mn2(OH)2SO4+O2=2Mn3O4+3H2SO4,则Mn2(OH)2SO4被O2氧化产生H+,而Mn(OH)2被O2氧化不产生H+,根据图象通入O2时15~150分钟pH越来越小,酸性增强,则15~150分钟滤饼中一定参与反应的成分是Mn2(OH)2SO4;故答案为:Mn2(OH)2SO4;3 Mn2(OH)2SO4+O2===2Mn3O4+3H2SO4;
(5)高温煅烧生成锰酸锂的化学方程式:8Mn3O4 +6Li2CO3 +5O2![]() 6CO2 + 12LiMn2O4。
6CO2 + 12LiMn2O4。