题目内容
【题目】下列叙述正确的是
A. 0.1mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
B. Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
C. 在Na2S溶液中加入AgC1固体,溶液中c(S2-)下降
D. pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等
【答案】C
【解析】分析:A项,C6H5ONa属于强碱弱酸盐,C6H5O-水解使C6H5ONa溶液呈碱性;B项,Na2CO3属于强碱弱酸盐,CO32-水解使Na2CO3溶液呈碱性,加水稀释促进CO32-水解,由于溶液体积增大,c(OH-)减小,pH减小,温度不变Kw不变;C项,AgCl转化成更难溶的Ag2S,溶液中c(S2-)下降;D项,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中c(H+)都为1![]() 10-5mol/L。
10-5mol/L。
详解:A项,C6H5ONa属于强碱弱酸盐,C6H5O-水解使C6H5ONa溶液呈碱性,溶液中离子浓度由大到小的顺序为c(Na+)![]() c(C6H5O-)
c(C6H5O-)![]() c(OH-)
c(OH-)![]() c(H+),A项错误;B项,Na2CO3属于强碱弱酸盐,CO32-水解使Na2CO3溶液呈碱性,加水稀释促进CO32-水解,由于溶液体积增大,c(OH-)减小,pH减小,温度不变Kw不变,B项错误;C项,Ag2S的溶解度小于AgCl,在Na2S溶液中加入AgCl固体,AgCl转化成更难溶的Ag2S,溶液中c(S2-)下降,发生的反应为:2AgCl+S2-=Ag2S+2Cl-,C项正确;D项,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中c(H+)都为1
c(H+),A项错误;B项,Na2CO3属于强碱弱酸盐,CO32-水解使Na2CO3溶液呈碱性,加水稀释促进CO32-水解,由于溶液体积增大,c(OH-)减小,pH减小,温度不变Kw不变,B项错误;C项,Ag2S的溶解度小于AgCl,在Na2S溶液中加入AgCl固体,AgCl转化成更难溶的Ag2S,溶液中c(S2-)下降,发生的反应为:2AgCl+S2-=Ag2S+2Cl-,C项正确;D项,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中c(H+)都为1![]() 10-5mol/L,两溶液中c(H+)相等,D项错误;答案选C。
10-5mol/L,两溶液中c(H+)相等,D项错误;答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列实验操作、现象与结论均正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 25℃,两片相同的Al片分别和等体积的稀HNO3和浓HNO3反应 | 前者产生无色气体,后者产生红棕色气体,且后者反应更加剧烈 | 其他条件相同时,反应物浓度越大,反应速率越快 |
B | 往黄色固体难溶物PbI2中加水,振荡,静置。取上层清液,然后加入NaI固体 | 产生黄色沉淀 | 难溶物PbI2存在沉淀溶解平衡 |
C | 向蛋白质溶液中分别加入乙醇溶液和(NH4)2SO4饱和溶液 | 均产生白色沉淀 | 蛋白质均发生了变性 |
D | 向稀硫酸中加入铜片,然后通入氧气加热 | 开始无明显现象,通入氧气加热后溶液变蓝 | 氧化性:稀硫酸> Cu2+ |
A. A B. B C. C D. D
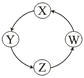
【题目】下列各组物质中,满足表中图示物质在通常条件下能一步转化的全部组合是
序号 | X | Y | Z | W |
|
Al | NaAlO2 | Al(OH)3 | Al2O3 | ||
② | Na | NaOH | Na2CO3 | NaCl | |
③ | C | CO | CO2 | H2CO3 | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A. ①② B. ①③④ C. ②③ D. ①④