题目内容
【题目】按要求填空
(1)烷烃A在同温、同压下蒸气的密度是![]() 的43倍,其分子式为______。
的43倍,其分子式为______。
(2)![]() 烷烃E完全燃烧,消耗标准状况下的
烷烃E完全燃烧,消耗标准状况下的![]()
![]() ,其分子式为______。
,其分子式为______。
(3)用式量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为______。
(4)某有机物的结构表达式为![]() ,其名称是______。
,其名称是______。
(5)萘的结构式为![]() ,其分子式为______。
,其分子式为______。
(6)立方烷![]() 的六氯代物有______种。
的六氯代物有______种。
【答案】C6H14 C3H8 6 5-甲基-2-庚烯 C10H8 3
【解析】
(1)根据同温、同压下,气体的密度之比等于相对分子质量之比,首先计算A的相对分子质量,再根据烷烃的通式CnH2n+2计算判断;
(2)根据烷烃燃烧的通式分析计算;
(3)烷基的通式为-CnH2n+1,根据式量确定烷基的种类,利用等效H判断甲苯苯环上的H原子种类,据此分析判断;
(4)该有机物主链含有7个C,且含有碳碳双键,根据烯烃的命名规则命名;
(5)根据结构简式分析判断萘的分子式;
(6)根据立方烷的结构分析判断其二氯代物的同分异构体数目,六氯代物与二氯代物的同分异构体数目相同,据此分析判断。
(1)同温、同压下,气体的密度之比等于相对分子质量之比,因此M(A)=43×2=86,设烷烃为CnH2n+2,则12n+2n+2=86,解得n=6,分子式为C6H14,故答案为:C6H14;
(2)0.1 mol烷烃E完全燃烧消耗O2的物质的量为![]() =0.5 mol,所以1molE完全燃烧,消耗
=0.5 mol,所以1molE完全燃烧,消耗![]() =5mol氧气,根据反应CnH2n+2+
=5mol氧气,根据反应CnH2n+2+![]() O2→nCO2+(n+1)H2O,可得:
O2→nCO2+(n+1)H2O,可得:![]() =5,解得:n=3,则E的分子式为C3H8,故答案为:C3H8;
=5,解得:n=3,则E的分子式为C3H8,故答案为:C3H8;
(3)烷基组成通式为-CnH2n+1,烷基式量为43,所以14n+1=43,解得n=3,所以该烷基为-C3H7,可以为正丙基和异丙基。当为正丙基时,甲苯苯环上的H原子种类有3种,所以有3种同分异构体;当为异丙基时,甲苯苯环上的H原子种类有3种,所以也有3种同分异构体,故该芳香烃产物的种类数为6种,故答案为:6;
(4)有机物![]() 主链含有7个C,且含有碳碳双键,为5-甲基-2-庚烯,故答案为:5-甲基-2-庚烯;
主链含有7个C,且含有碳碳双键,为5-甲基-2-庚烯,故答案为:5-甲基-2-庚烯;
(5)![]() 的结构中含10个碳原子,8个H原子,故分子式为C10H8,故答案为:C10H8;
的结构中含10个碳原子,8个H原子,故分子式为C10H8,故答案为:C10H8;
(6)立方烷(![]() )中含8个碳原子,每个碳原子上连一个H原子;立方烷的二氯代物的同分异构体分别是:一条棱、面对角线、体对角线上的两个氢原子被氯原子代替,所以二氯代物的同分异构体有3种;分子中共含有8个H原子,则六氯代物与二氯代物的同分异构体数目相同,六氯代物的同分异构体有3种,故答案为:3。
)中含8个碳原子,每个碳原子上连一个H原子;立方烷的二氯代物的同分异构体分别是:一条棱、面对角线、体对角线上的两个氢原子被氯原子代替,所以二氯代物的同分异构体有3种;分子中共含有8个H原子,则六氯代物与二氯代物的同分异构体数目相同,六氯代物的同分异构体有3种,故答案为:3。

 全优点练单元计划系列答案
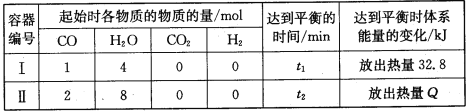
全优点练单元计划系列答案【题目】某学生用0.10 mol·L-1标准NaOH溶液滴定某浓度的盐酸。记录数据如下:
实验 序号 | 待测液 体积/mL | 所消耗NaOH标准液的体积/mL | |
滴定前读数/mL | 滴定后读数/mL | ||
1 | 20.00 | 0.50 | 20.54 |
2 | 20.00 | 6.00 | 26.00 |
3 | 20.00 | 1.40 | 21.36 |

(1)滴定时选用酚酞试液作指示剂,如何判断滴定达到终点____________。
(2)滴定过程中,眼睛应注视_____________________;
(3)盐酸的物质的量浓度为___________。
(4)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是__________(填“偏高”“偏低”或“无影响”)。
(5)某同学用已知准确浓度的高锰酸钾溶液滴定溶液中Fe2+的浓度,高锰酸钾溶液应盛放在________(填“甲”或“乙”)中,该反应的离子方程式为_______________