题目内容
18.小组同学查阅资料,得到了Na2CO3(aq)与盐酸反应过程中的能量变化示意图如下.下列说法错误的是( )
(注:碳酸钠与碳酸氢钠的溶解过程的热效应忽略不计)
| A. | △H1<△H2 | |
| B. | 若反应HCO3-+H+=CO2↑+H2O的熵增效应大于吸热效应,则其在常温常下能自发进行 | |
| C. | CO32-(aq)+2H+(aq)=CO2(g)+H2O(l)△H=(△H1+△H2-△H3) kJ/mol | |
| D. | 相同条件下,结合H+的能力:CO32->HCO3- |
分析 A.放热反应,放出的热量越多,反应热越小;
B.当△G=△H-T•△S<0时,反应能自发进行;
C.先根据图象写出热化学方程式,再根据盖斯定律来解答;
D.相同条件下,CO32-结合H+的能力强.
解答 解:A.两个反应都为放热反应,放热反应,放出的热量越多,反应热越小,所以△H1<△H2,故A正确;
B.反应能自发进行,应有△G=△H-T•△S<0,因△H>0,则△H<T•△S,说明熵增效应大于能量效应,故B正确;
C.根据图象可得热化学方程式为:CO32-(aq)+2H+(aq)=HCO3-(aq)+H+(aq)△H1 ①
HCO3-(aq)+H+(aq)=H2CO3(aq)△H2 ②
H2CO3(aq)=CO2(g)+H2O(l)△H3 ③
根据盖斯定律,①+②+③可得:CO32-(aq)+2H+(aq)=CO2(g)+H2O(l)△H=(△H1+△H2+△H3)kJ/mol,故C错误;
D.相同条件下,结合H+的能力:CO32->HCO3-,故D正确;
故选C.
点评 本题考查了反应热、化学反应速率与化学平衡知识,意在考查考生对化学反应原理的综合运用能力.

练习册系列答案
 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
9.图中横坐标表示完全燃烧时耗用可燃气体X(X=A、B、C)的物质的量n(X),纵坐标表示消耗O2的物质的量n(O2),A、B是两种可燃性气体,C是A、B的混合气体,则C中n(A):n(B) 为( )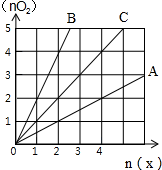
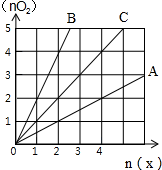
| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 任意 |
6.下表是周期表中的一部分,根据A-N在周期表中的位置,按要求回答下列问题:
(1)表中元素,氧化性最强的单质是F2,还原性最强的单质是Na(用相关的元素符号或分子式表示)
(2)最高价氧化物的水化物酸性最强的是高氯酸,呈两性的是氢氧化铝.(本小题均填物质的名称)
(3)在B、C、D、F、G、H中,原子半径从大到小的顺序为的是Na>Mg>Al>C>N>F.(用元素符号表示).
(4)在D、F、M的离子半径从大到小的顺序为的是Cl->F->Na+.(用离子符号表示).
(5)F的最高价氧化物对应的水化物和H的最高价氧化物对应的水化物反应的离子方程式是Al(OH)3+OH-═AlO2-+2H2O.
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | M | N |
(2)最高价氧化物的水化物酸性最强的是高氯酸,呈两性的是氢氧化铝.(本小题均填物质的名称)
(3)在B、C、D、F、G、H中,原子半径从大到小的顺序为的是Na>Mg>Al>C>N>F.(用元素符号表示).
(4)在D、F、M的离子半径从大到小的顺序为的是Cl->F->Na+.(用离子符号表示).
(5)F的最高价氧化物对应的水化物和H的最高价氧化物对应的水化物反应的离子方程式是Al(OH)3+OH-═AlO2-+2H2O.
3.烷烃分子可以看作由以下基团组合而成:-CH3、-CH2-、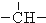 、
、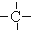 .如某烷烃分子中同时存在这四种基团,-CH2-、
.如某烷烃分子中同时存在这四种基团,-CH2-、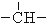 、
、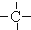 分别为m、n、a个,则该烷烃中-CH3的数目应是( )
分别为m、n、a个,则该烷烃中-CH3的数目应是( )
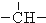 、
、 .如某烷烃分子中同时存在这四种基团,-CH2-、
.如某烷烃分子中同时存在这四种基团,-CH2-、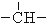 、
、 分别为m、n、a个,则该烷烃中-CH3的数目应是( )
分别为m、n、a个,则该烷烃中-CH3的数目应是( )| A. | 2m+3n+4a | B. | m+2n+2a | C. | n+2a+2 | D. | m+n+2a |
10.下列叙述不正确的是( )
| A. | 原子核外每层最多容纳的电子数为2n2个(n为电子层) | |
| B. | 同一原子核外的M层上的电子数一定比L层上的电子数多 | |
| C. | 如果原子只有一个电子层,该原子的质子数不超过2个 | |
| D. | 1~18号元素,每层电子数都满足2n2个电子的元素只有2种 |
7.化学与能源开发、环境保护、生产生活等密切相关.下列有关说法正确的是( )
| A. | 二氧化硫可用于纸浆漂白,表明二氧化硫具有还原性 | |
| B. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| C. | 为防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 | |
| D. | Na2O2可用作呼吸面具的供氧剂 |
8.现有常温下水电离出的c(H+)均为1×10-11mol/L的4种溶液:①HCl溶液;②CH3COOH溶液;③NaOH溶液;④氨水.有关上述溶液的比较中,正确的是( )
| A. | 向等体积溶液中分别加水稀释100倍后,溶液的pH:③>④>②>① | |
| B. | 等体积的①、②、③溶液分别与足量铝粉反应,生成H2的量①最小 | |
| C. | ②、③溶液等体积混合后,溶液显碱性 | |
| D. | ①、④溶液混合若pH=7,则消耗溶液的体积:④>① |
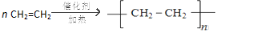 .
.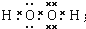 ;将乙加入浅绿色酸性溶液中,溶液变为棕黄色,写出该反应的离子方程式.
;将乙加入浅绿色酸性溶液中,溶液变为棕黄色,写出该反应的离子方程式. .与PH3相比,DC2易液化的主要原因是NH3中有氢键;
.与PH3相比,DC2易液化的主要原因是NH3中有氢键;