题目内容
3.烷烃分子可以看作由以下基团组合而成:-CH3、-CH2-、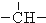 、
、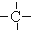 .如某烷烃分子中同时存在这四种基团,-CH2-、
.如某烷烃分子中同时存在这四种基团,-CH2-、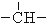 、
、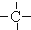 分别为m、n、a个,则该烷烃中-CH3的数目应是( )
分别为m、n、a个,则该烷烃中-CH3的数目应是( )| A. | 2m+3n+4a | B. | m+2n+2a | C. | n+2a+2 | D. | m+n+2a |
分析 根据烷烃通式结合基团的结构特点分析,有机物主要靠C原子连接,每个碳原子都必须形成4个共价键,1个 含有1个氢原子,1个-CH2-含有2个氢原子,1个-CH3含有3个氢原子,据此分析计算判断.
含有1个氢原子,1个-CH2-含有2个氢原子,1个-CH3含有3个氢原子,据此分析计算判断.
解答 解:饱和烷烃的通式为:CnH2n+2,设烷烃中-CH3的数目为X个,某烷烃分子中同时存在这四种基团,-CH2-、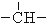 、
、 分别为m、n、a个,碳原子个数是:m+n+a+X,氢原子个数是:2m+n+3X,由烷烃的通式知:氢原子数目是:2(m+n+a+X)+2,根据氢原子守恒:2(m+n+a+X)+2=2m+n+3X,所以X=n+2a+2,
分别为m、n、a个,碳原子个数是:m+n+a+X,氢原子个数是:2m+n+3X,由烷烃的通式知:氢原子数目是:2(m+n+a+X)+2,根据氢原子守恒:2(m+n+a+X)+2=2m+n+3X,所以X=n+2a+2,
故选C.
点评 本题考查有机物的结构,题目难度中等,关键清楚烷烃中基团与氢原子之间的数量关系,注意有机物主要靠C原子连接,每个碳原子都必须形成4个共价键.

练习册系列答案
相关题目
15.向a mol BaCl2、AlCl3和FeCl3的混合液A中,逐滴加入Na2SO4和NaOH的混合液B,产生沉淀的物质的量n与加入溶液B的体积关系如图所示,下列叙述正确的是( )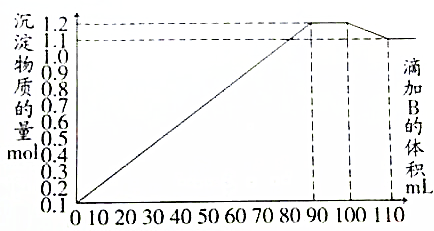

| A. | 加入90mL B时,A溶液中金属离子沉淀完全 | |
| B. | 加入110mL B时,沉淀物仅为BaSO4 | |
| C. | B溶液中Na2SO4和NaOH的物质的量浓度之比为1:1 | |
| D. | 当溶液中含有NaAlO2时,加入溶液B的体积V(B)≥100mL |
11.某非金属元素X的最高化合价为+m,其最高价氧化物的水化物的分子中有b个氧原子,则该元素最高价氧化物的水化物的分子式为( )
| A. | Hm+2bXOb | B. | Hm-2bXOb | C. | Hb+mXOb | D. | H2b-mXOb |
18.小组同学查阅资料,得到了Na2CO3(aq)与盐酸反应过程中的能量变化示意图如下.下列说法错误的是( )

(注:碳酸钠与碳酸氢钠的溶解过程的热效应忽略不计)

(注:碳酸钠与碳酸氢钠的溶解过程的热效应忽略不计)
| A. | △H1<△H2 | |
| B. | 若反应HCO3-+H+=CO2↑+H2O的熵增效应大于吸热效应,则其在常温常下能自发进行 | |
| C. | CO32-(aq)+2H+(aq)=CO2(g)+H2O(l)△H=(△H1+△H2-△H3) kJ/mol | |
| D. | 相同条件下,结合H+的能力:CO32->HCO3- |
8.下列说法正确的是( )
| A. | 常温下稀释溶液0.1mol•L-1CH3COONa溶液,$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$变大 | |
| B. | 向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 25℃时,pH=3的硫酸溶液中水的电离程度大于pH=11的氨水溶液中水的电离程度 | |
| D. | 等浓度的NaCl和CH3COONa等体积混合,则混合溶液中:c(Na+)>c(Cl-)>c(OH-)>c(CH3COO-)>c(H+) |
15.如图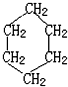 是环己烷的结构简式,下列说法不正确的是( )
是环己烷的结构简式,下列说法不正确的是( )
 是环己烷的结构简式,下列说法不正确的是( )
是环己烷的结构简式,下列说法不正确的是( )| A. | 环己烷不属于烃 | |
| B. | 环己烷的分子式为C6H12 | |
| C. | 环己烷是苯和氢气加成产物 | |
| D. | 1 mol环己烷完全燃烧消耗氧气的物质的量为9 mol |
12.去年在西非国家爆发了埃博拉疫情.已知该病情对某些化学药品敏感,乙醇、高锰酸钾溶液、次氯酸钾溶液、双氧水等消毒剂可以完全灭活病毒感染性.下列说法正确的是( )
| A. | 次氯酸的结构式为H-O-Cl | |
| B. | 过氧化氢的电子式为 | |
| C. | 在此氯酸钠溶液中通过少量二氧化硫可得到亚硫酸钠和次氯酸 | |
| D. | 乙醇、高锰酸钾溶液和双氧水均可以将该病毒氧化而达到消毒的目的 |
13.下列说法正确的是( )
| A. | 葡萄糖、油脂、蛋白质在一定条件下均可以发生水解反应 | |
| B. | 赤铁矿、磁铁矿、黄铁矿、孔雀石都是常见的铁矿石 | |
| C. | 石油分馏、煤的气化、海水制食盐、纤维素加工等过程都包含化学变化 | |
| D. | “地沟油”经过加工处理后可以用来制肥皂 |
 (Ⅰ)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等.
(Ⅰ)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等. .
.