题目内容
7.化学与能源开发、环境保护、生产生活等密切相关.下列有关说法正确的是( )| A. | 二氧化硫可用于纸浆漂白,表明二氧化硫具有还原性 | |
| B. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| C. | 为防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 | |
| D. | Na2O2可用作呼吸面具的供氧剂 |
分析 A.二氧化硫具有漂白性,可用于纸浆漂白;
B.煤的气化和液化为化学变化;
C.生石灰不具有还原性;
D.过氧化钠可与二氧化碳、水等发生氧化还原反应.
解答 解:A.二氧化硫具有漂白性,可用于纸浆漂白,与二氧化硫的还原性无关,故A错误;
B.煤的气化和液化分别生成CO、氢气以及甲醇等,为化学变化,故B错误;
C.生石灰具有吸水性,可防止食品变潮,不具有还原性,故C错误;
D.过氧化钠可与二氧化碳、水等发生氧化还原反应,可用于供氧剂,故D正确.
故选D.
点评 本题综合考查元素化合物知识,为高频考点,侧重化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
相关题目
17.化学与社会、生产、生活紧切相关,下列说法正确的是( )
| A. | 信息产业中的光缆的主要成份是单质硅 | |
| B. | NO2、CO2、SO2、PM2.5颗粒都会导致酸雨 | |
| C. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| D. | 发酵粉能使焙制出的糕点疏松多孔,是因为发酵粉中含有碳酸氢钠 |
18.小组同学查阅资料,得到了Na2CO3(aq)与盐酸反应过程中的能量变化示意图如下.下列说法错误的是( )

(注:碳酸钠与碳酸氢钠的溶解过程的热效应忽略不计)

(注:碳酸钠与碳酸氢钠的溶解过程的热效应忽略不计)
| A. | △H1<△H2 | |
| B. | 若反应HCO3-+H+=CO2↑+H2O的熵增效应大于吸热效应,则其在常温常下能自发进行 | |
| C. | CO32-(aq)+2H+(aq)=CO2(g)+H2O(l)△H=(△H1+△H2-△H3) kJ/mol | |
| D. | 相同条件下,结合H+的能力:CO32->HCO3- |
15.如图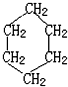 是环己烷的结构简式,下列说法不正确的是( )
是环己烷的结构简式,下列说法不正确的是( )
 是环己烷的结构简式,下列说法不正确的是( )
是环己烷的结构简式,下列说法不正确的是( )| A. | 环己烷不属于烃 | |
| B. | 环己烷的分子式为C6H12 | |
| C. | 环己烷是苯和氢气加成产物 | |
| D. | 1 mol环己烷完全燃烧消耗氧气的物质的量为9 mol |
2.下列说法中正确的是( )
| A. | 分子式为C4H9Cl的物质一共有4种结构 | |
| B. | 可以用酸性KMnO4溶液除去甲烷中的乙烯 | |
| C. | 2,2-二甲基丙烷中所有碳原子在同一平面上 | |
| D. | CH3-CH=CH-CH3与HCl发生加成反应,产物有两种 |
12.去年在西非国家爆发了埃博拉疫情.已知该病情对某些化学药品敏感,乙醇、高锰酸钾溶液、次氯酸钾溶液、双氧水等消毒剂可以完全灭活病毒感染性.下列说法正确的是( )
| A. | 次氯酸的结构式为H-O-Cl | |
| B. | 过氧化氢的电子式为 | |
| C. | 在此氯酸钠溶液中通过少量二氧化硫可得到亚硫酸钠和次氯酸 | |
| D. | 乙醇、高锰酸钾溶液和双氧水均可以将该病毒氧化而达到消毒的目的 |
19.运用相关化学知识进行判断,下列结论正确的是( )
| A. | PM2.5表示每立方米空气中直径小于或等于2.5μm的颗粒物的含量,PM2.5值越高,大气污染越严重,因此由PM2.5引起的雾霾一定属于胶体 | |
| B. | 分光光度计可用于分析溶液颜色与反应物(或生成物)浓度的关系,从而确定化学反应速率 | |
| C. | 对“地沟油”加工处理可以达到变废为宝的目的,比如对“地沟油”进行分馏可以制得汽油、煤油 | |
| D. | 次氯酸和臭氧都是强氧化剂,都能杀死水中的细菌.自来水常用氯气来杀菌消毒,是因为氯气杀菌消毒效果要比臭氧好,且不会残留有毒、有害物质 |
16.非金属元素H、C、O、S、Cl能形成的化合物种类很多,单质及化合物的用途很广泛.
(1)O2-的离子结构示意图为 ,CS2的晶体类型为分子 晶体;
,CS2的晶体类型为分子 晶体;
(2)O、Cl两元素形成的单质和化合物常用来杀菌消毒,试举例ClO2、O3、Cl2(写化学式,任写两种);
(3)CH3OH在常温下为液态,沸点高于乙烷的主要原因是甲醇分子之间能形成氢键而乙烷不能;
(4)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
①用离子方程式表示“泄漏处理”中NaHSO3溶液的作用HSO3-+Cl2+H2O=SO42-+3H++2Cl-.
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是Fe(FeCl3)能催化苯与氯气的反应.
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3.当溶液中c(Cl-):c(ClO-)=11:1时,则c(ClO-):c(ClO3-)比值等于1:2
(5)镁是一种较活泼的金属,Mg与Ca类似,也能与C形成某种易水解的离子化合物.已知该化合物0.1mol与水完全反应后,产生0.1mol的某种气体.该气体被溴水全部吸收后,溴水增重2.8g.请写出该水解反应方程式MgC+2H2O=Mg(OH)2+C2H4.
(1)O2-的离子结构示意图为
 ,CS2的晶体类型为分子 晶体;
,CS2的晶体类型为分子 晶体;(2)O、Cl两元素形成的单质和化合物常用来杀菌消毒,试举例ClO2、O3、Cl2(写化学式,任写两种);
(3)CH3OH在常温下为液态,沸点高于乙烷的主要原因是甲醇分子之间能形成氢键而乙烷不能;
(4)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是Fe(FeCl3)能催化苯与氯气的反应.
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3.当溶液中c(Cl-):c(ClO-)=11:1时,则c(ClO-):c(ClO3-)比值等于1:2
(5)镁是一种较活泼的金属,Mg与Ca类似,也能与C形成某种易水解的离子化合物.已知该化合物0.1mol与水完全反应后,产生0.1mol的某种气体.该气体被溴水全部吸收后,溴水增重2.8g.请写出该水解反应方程式MgC+2H2O=Mg(OH)2+C2H4.
17. 如图是检验气体性质的实验装置.向装置中缓慢通入气体X,若关闭活塞K,品红溶液无变化、澄清石灰水变浑浊;若打开活塞K,品红溶液褪色.据此判断,气体X和液体Y可能是( )
如图是检验气体性质的实验装置.向装置中缓慢通入气体X,若关闭活塞K,品红溶液无变化、澄清石灰水变浑浊;若打开活塞K,品红溶液褪色.据此判断,气体X和液体Y可能是( )
 如图是检验气体性质的实验装置.向装置中缓慢通入气体X,若关闭活塞K,品红溶液无变化、澄清石灰水变浑浊;若打开活塞K,品红溶液褪色.据此判断,气体X和液体Y可能是( )
如图是检验气体性质的实验装置.向装置中缓慢通入气体X,若关闭活塞K,品红溶液无变化、澄清石灰水变浑浊;若打开活塞K,品红溶液褪色.据此判断,气体X和液体Y可能是( )| 选项 物质 | A | B | C | D |
| X | H2S | SO2 | CO2 | Cl2 |
| Y | 浓硫酸 | NaHCO3饱和溶液 | Na2SO3 溶液 | NaHSO3 溶液 |
| A. | A | B. | B | C. | C | D. | D |