题目内容
6.下表是周期表中的一部分,根据A-N在周期表中的位置,按要求回答下列问题:| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | M | N |
(2)最高价氧化物的水化物酸性最强的是高氯酸,呈两性的是氢氧化铝.(本小题均填物质的名称)
(3)在B、C、D、F、G、H中,原子半径从大到小的顺序为的是Na>Mg>Al>C>N>F.(用元素符号表示).
(4)在D、F、M的离子半径从大到小的顺序为的是Cl->F->Na+.(用离子符号表示).
(5)F的最高价氧化物对应的水化物和H的最高价氧化物对应的水化物反应的离子方程式是Al(OH)3+OH-═AlO2-+2H2O.
分析 由元素在周期表中位置可知:A为H元素、B为C元素、C为N元素、D为F元素、E为He元素、F为Na元素、G为Mg元素、H为Al元素、I为Si元素、J为P元素、K为S元素、M为Cl元素、N为Ar元素,
(1)以上各元素中,非金属性最强的为F,形成单质氧化性正确的为氟气;还原性最强的单质为金属钠;
(2)非金属性越强,最高价氧化物的水化物酸性越强,F没有最高价,则最高价氧化物对应水化物酸性最强的为Cl元素;最高价氧化物对应的水化物呈两性的氢氧化铝,
(3)原子的电子层越多,原子半径越大,电子层相同时,原子的核电荷数越大,原子半径越小,据此判断该原子半径大小;
(4)离子的电子层越多,离子半径越大,电子层相同时,离子的核电荷数越大,据此比较各离子半径大小;
(5)F的最高价氧化物对应的水化物为氢氧化钠,H的最高价氧化物对应的水化物为氢氧化铝,二者反应生成偏铝酸钠和水.
解答 解:由元素在周期表中位置可知:A为H元素、B为C元素、C为N元素、D为F元素、E为He元素、F为Na元素、G为Mg元素、H为Al元素、I为Si元素、J为P元素、K为S元素、M为Cl元素、N为Ar元素,
(1)以上各元素中,非金属性最强的为F,形成单质氧化性正确的为F2;还原性最强的单质为Na,
故答案为:F2;Na;
(2)非金属性越强,最高价氧化物的水化物酸性越强,则酸性最强的为高氯酸;最高价氧化物对应的水化物呈两性的氢氧化铝,
故答案为:高氯酸;氢氧化铝;
(3)原子的电子层越多,原子半径越大,电子层相同时,原子的核电荷数越大,原子半径越小,则各原子的原子半径大小为:Na>Mg>Al>C>N>F,
故答案为:Na>Mg>Al>C>N>F;
(4)离子的电子层越多,离子半径越大,电子层相同时,离子的核电荷数越大,离子半径越小,则各离子半径大小为:Cl->F->Na+,
故答案为:Cl->F->Na+;
(5)F的最高价氧化物对应的水化物为氢氧化钠,H的最高价氧化物对应的水化物为氢氧化铝,氢氧化铝与氢氧化铝反应生成偏铝酸钠和水,反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O.
点评 本题考查了元素周期表与元素周期律的综合应用,题目难度中等,熟练掌握元素周期表结构、元素周期律的内容为解答关键,注意明确粒子比较与电子层数、核电荷数为关系,试题培养了学生灵活应用基础知识的能力.

| A. | 信息产业中的光缆的主要成份是单质硅 | |
| B. | NO2、CO2、SO2、PM2.5颗粒都会导致酸雨 | |
| C. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| D. | 发酵粉能使焙制出的糕点疏松多孔,是因为发酵粉中含有碳酸氢钠 |
| A. | Hm+2bXOb | B. | Hm-2bXOb | C. | Hb+mXOb | D. | H2b-mXOb |

(注:碳酸钠与碳酸氢钠的溶解过程的热效应忽略不计)
| A. | △H1<△H2 | |
| B. | 若反应HCO3-+H+=CO2↑+H2O的熵增效应大于吸热效应,则其在常温常下能自发进行 | |
| C. | CO32-(aq)+2H+(aq)=CO2(g)+H2O(l)△H=(△H1+△H2-△H3) kJ/mol | |
| D. | 相同条件下,结合H+的能力:CO32->HCO3- |
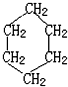 是环己烷的结构简式,下列说法不正确的是( )
是环己烷的结构简式,下列说法不正确的是( )| A. | 环己烷不属于烃 | |
| B. | 环己烷的分子式为C6H12 | |
| C. | 环己烷是苯和氢气加成产物 | |
| D. | 1 mol环己烷完全燃烧消耗氧气的物质的量为9 mol |
(1)O2-的离子结构示意图为
 ,CS2的晶体类型为分子 晶体;
,CS2的晶体类型为分子 晶体;(2)O、Cl两元素形成的单质和化合物常用来杀菌消毒,试举例ClO2、O3、Cl2(写化学式,任写两种);
(3)CH3OH在常温下为液态,沸点高于乙烷的主要原因是甲醇分子之间能形成氢键而乙烷不能;
(4)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是Fe(FeCl3)能催化苯与氯气的反应.
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3.当溶液中c(Cl-):c(ClO-)=11:1时,则c(ClO-):c(ClO3-)比值等于1:2
(5)镁是一种较活泼的金属,Mg与Ca类似,也能与C形成某种易水解的离子化合物.已知该化合物0.1mol与水完全反应后,产生0.1mol的某种气体.该气体被溴水全部吸收后,溴水增重2.8g.请写出该水解反应方程式MgC+2H2O=Mg(OH)2+C2H4.
 A~G为原子序数依次增大的短周期主族元素,A原子与其他元素不处于同一周期,元素B的基态原子核外电子共有6种运动状态,D、F同族,D原子的基态原子价电子排布式均为ns2npn+2,E元素所在周期中,E气态基态原子的第一电离能力最小,试回答下列问题:(均用元素符号表示).
A~G为原子序数依次增大的短周期主族元素,A原子与其他元素不处于同一周期,元素B的基态原子核外电子共有6种运动状态,D、F同族,D原子的基态原子价电子排布式均为ns2npn+2,E元素所在周期中,E气态基态原子的第一电离能力最小,试回答下列问题:(均用元素符号表示). (Ⅰ)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等.
(Ⅰ)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等. .
.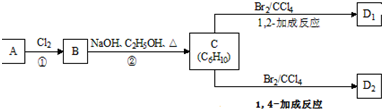
 .
.