题目内容
【题目】查阅资料:元素铬(Cr)在溶液中主要以Cr3+(蓝紫色) 、Cr(OH)4-(绿色) 、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
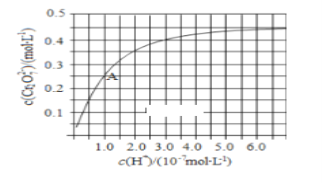
(1)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如右图所示。
①用离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性增大,CrO42的平衡转化率________(填“增大“减小”或“不变”)。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH____0(填“>”“<”或“=”)。
(2)欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去.已知:某含铬废水处理的主要流程如图所示:
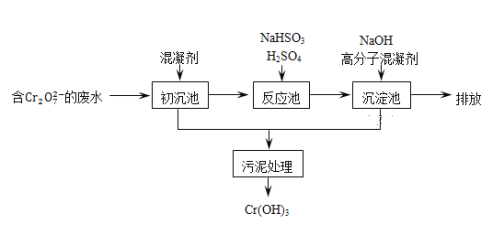
①初沉池中加入的混凝剂是K2SO4·Al2(SO4)3·24H2O,其作用为__________(用离子方程式表示).
②反应池中用NaHSO3将酸性废液中的Cr2O72-还原成Cr3+,该反应的离子方程式为________.根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子的先后顺序是____________。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.2 |
Cr3+ | 6.0 | 8.0 |
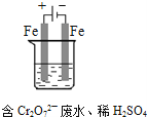
(3)工业可用电解法来处理含 Cr2O72-废水。实验室利用如图模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-═H2↑,Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是__________,得到的金属阳离子在阴极区可沉淀完全,用电解法处理该溶液中0.01mol Cr2O72-时,至少得到沉淀的质量是__________ g。
【答案】2CrO42-+2H+![]() Cr2O72- +H2O 增大 < Al3+ + 3H2O
Cr2O72- +H2O 增大 < Al3+ + 3H2O![]() Al(OH)3(胶体) + 3H+ Cr2O72- +3HSO3- +5H+=2Cr3++3SO42- +4H2O H+、Cr3+ 6Fe2++Cr2O72- +14H+=6Fe3++2Cr3++7H2O 8.48
Al(OH)3(胶体) + 3H+ Cr2O72- +3HSO3- +5H+=2Cr3++3SO42- +4H2O H+、Cr3+ 6Fe2++Cr2O72- +14H+=6Fe3++2Cr3++7H2O 8.48
【解析】
(1)①图象分析可知随氢离子浓度增大,铬酸根离子转化为重铬酸根离子;
②溶液酸性增大,平衡2CrO42-+2H+![]() Cr2O72- +H2O正向进行,CrO42-的平衡转化率增大;
Cr2O72- +H2O正向进行,CrO42-的平衡转化率增大;
③升高温度,溶液中CrO42-的平衡转化率减小,平衡逆向移动,升高温度平衡向吸热方向移动,据此判断;
(2)含Cr2O72-废水中加入明矾,铝离子水解生成具有吸附性的氢氧化铝,可除去水的悬浮物杂质,然后加入硫酸和亚硫酸氢钠,在酸性条件下发生Cr2O72- +3HSO3- +5H+=2Cr3++3SO42- +4H2O,充分反应后,加入氢氧化钠溶液可生成Cr(OH)3沉淀,通过污泥处理过滤除去氢氧化铬,分离后可达到排放的目的,
(3)Fe2+离子与Cr2O72-离子发生氧化还原反应生成Fe3+离子和Cr3+离子;根据6Fe2++Cr2O72- +14H+=6Fe3++2Cr3++7H2O、Cr3++3OH-=Cr(OH)3↓、Fe3++3OH-=Fe(OH)3↓进行计算。
(1) ①随着H+浓度的增大,CrO42-转化为Cr2O72-的离子反应式为:2CrO42-+2H+![]() Cr2O72- +H2O;
Cr2O72- +H2O;
②溶液酸性增大,平衡2CrO42-+2H+![]() Cr2O72- +H2O正向进行,CrO42-的平衡转化率增大;故答案为:增大;
Cr2O72- +H2O正向进行,CrO42-的平衡转化率增大;故答案为:增大;
③升高温度,溶液中CrO42-的平衡转化率减小,平衡逆向移动,说明正方向放热,则该反应的H<0。故答案为:<;
(2)、①K2SO4·Al2(SO4)3·24H2O为强电解质,在溶液中完全电离,生成Al3+和SO42-、K+,Al3+能水解生成氢氧化铝胶体可除去水的悬浮物杂质,故答案为:Al3+ + 3H2O![]() Al(OH)3(胶体) + 3H+;
Al(OH)3(胶体) + 3H+;
②加入硫酸和亚硫酸氢钠,在酸性条件下发生Cr2O72- +3HSO3- +5H+=2Cr3++3SO42- +4H2O,充分反应后,溶液中有H+、Cr3+。根据“沉淀法”和“中和法”的原理,加入氢氧化钠溶液先与溶液中的H+反应,再和Cr3+反应生成Cr(OH)3沉淀,故答案为:Cr2O72- +3HSO3- +5H+=2Cr3++3SO42- +4H2O;H+、Cr3+;
(3) 亚铁离子与Cr2O72-发生氧化还原反应,被还原为Cr3+然后生成Cr(OH)3沉淀,重铬酸根具有强氧化性,能将生成的亚铁离子氧化为三价,即6Fe2++ Cr2O72-+14H+=6Fe3++2Cr
故答案为6Fe2++ Cr2O72-+14H+=6Fe3++2Cr3++7H2O;8.48g。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】乙酰苯胺(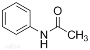 )在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等,可通过苯胺(
)在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等,可通过苯胺(![]() )和乙酸酐(
)和乙酸酐(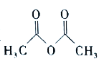 )反应制得。已知:纯乙酰苯胺是白色片状晶体,相对分子质量为135,熔点为114℃,易溶于有机溶剂。在水中的溶解度如下。
)反应制得。已知:纯乙酰苯胺是白色片状晶体,相对分子质量为135,熔点为114℃,易溶于有机溶剂。在水中的溶解度如下。
温度/℃ | 20 | 25 | 50 | 80 | 100 |
溶解度/(g/100g水) | 0.46 | 0.56 | 0.84 | 3.45 | 5.5 |
实验室制备乙酰苯胺的步骤如下(部分装置省略):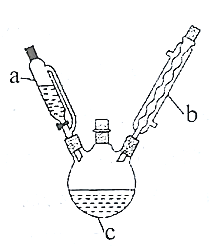
Ⅰ.粗乙酰苯胺的制备。将7mL(0.075mol)过量乙酸酐放入三颈烧瓶c中,在a中放入5mL(0.055mol)新制得的苯胺。将苯胺在室温下逐滴滴加到三颈烧瓶中。苯胺滴加完毕,在石棉网上用小火加热回流30min,使之充分反应。待反应完成,在不断搅拌下,趁热把反应混合物缓慢地倒入盛有100mL冷水的烧杯中,乙酰苯胺晶体析出。充分冷却至室温后,减压过滤,用__洗涤晶体2-3次。用滤液冲洗烧杯上残留的晶体,再次过滤,两次过滤得到的固体合并在一起。
Ⅱ.乙酰苯胺的提纯。将上述制得的粗乙酰苯胺固体移入250mL烧杯中,加入100mL热水,加热至沸腾,待粗乙酰苯胺完全溶解后,再补加少量蒸馏水。稍冷后,加入少量活性炭吸附色素等杂质,在搅拌下微沸5min,趁热过滤。待滤液冷却至室温,有晶体析出,__、洗涤、干燥后称量产品为5.40g。
回答下列问题:
(1)仪器b的名称是__。
(2)步骤I中,减压过滤的优点是过滤速度快,同时所得固体更干燥,用滤液而不用蒸馏水冲洗烧杯的原因是__;洗涤晶体最好选用__(填字母)。
A.乙醇 B.CCl4 C.冷水 D.乙醚
(3)步骤Ⅱ中,粗乙酰苯胺溶解后,补加少量蒸馏水的目的是__。
(4)步骤Ⅱ中,洗涤干燥前的操作是___。上述提纯乙酰苯胺的方法叫__。
(5)乙酰苯胺的产率为___。(计算结果保留3位有效数字)
【题目】实验室用如图所示装置制备氯气并进行一系列相关实验(夹持设备及必要的加热装置已省略)。
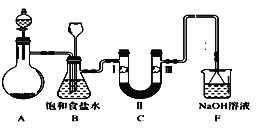
(1)整套装置装配完毕后,首先进行的操作是___,再添加试剂。
(2)实验室常用MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O制取氯气:
MnCl2+Cl2↑+2H2O制取氯气:
①实验时,通常采用密度为1.19g/cm3、浓度为36.5%的浓盐酸。该浓盐酸的物质的量浓度为____。
②标准状况下,上述反应每生成4.48L氯气,转移电子的物质的量为___mol。
(3)洗气装置B的作用是除去Cl2中的HCl气体,同时用作安全瓶(监测实验时装置C中是否发生堵塞)。若装置C发生堵塞,装置B中将观察到的现象是___。
(4)装置C的作用是验证氯气是否具有漂白性。为此,实验时装置C中I、II、III处依次放入的物质是____(填字母)。
A | B | C | D | |
I | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 无水氯化钙 | 无水氯化钙 | 浓硫酸 |
III | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 |
(5)向品红溶液中同时通入氯气和二氧化硫(按物质的量之比1:1),观察到的现象是___。用化学方程式解释一下原因___。
(6)F为尾气吸收装置。实验时,该装置中反应的离子方程式___。
【题目】用图所示装置检验乙烯时不需要除杂的是
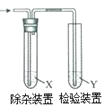
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |