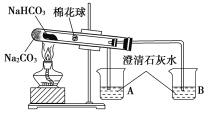
题目内容
【题目】已知A是一种常见金属,F 是一种红褐色沉淀,试根据图中转化关系,回答下列问题。
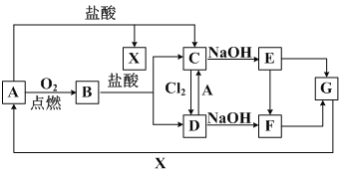
(1)写出A、C、F、G的化学式:A_________,C________,F________,G_________。
(2) 检验D中阳离子的方法为________________________
(3) 保存C溶液时要加固体A的原因__________________
(4) 写出下列转化的离子方程式或化学方程式。
①E→F 的化学反应方程式:_________________________
②C→D的离子反应方程式:_________________________
【答案】Fe FeCl2 Fe(OH)3 Fe2O3 取D溶液少许于试管中,加入几滴KSCN溶液,溶液变红色,证明含Fe3+(答案合理即可) 防止Fe2+被O2氧化变质 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Fe2++Cl2=2Fe3++2Cl-
【解析】
A是一种常见金属,F是一种红褐色沉淀,由转化关系可知F为Fe(OH)3,A为Fe,Fe与氧气反应生成B为Fe3O4,四氧化三铁与盐酸反应得到氯化亚铁与氯化铁,故Fe与盐酸反应得到X为氢气、C为FeCl2,可推知E为Fe(OH)2、D为FeCl3,G为Fe2O3。
(1)根据分析可知A为Fe,C为FeCl2,F为Fe(OH)3,G为Fe2O3,故答案为:Fe;FeCl2;Fe(OH)3;Fe2O3;
(2)D为FeCl3,含有阳离子为Fe3+,检验Fe3+离子的方法为:取少量D溶液于试管中,滴加几滴KSCN溶液,若溶液变红色,证明有Fe3+,故答案为:取D溶液少许于试管中,加入几滴KSCN溶液,溶液变红色,证明含Fe3+(答案合理即可);
(3)FeCl2易被空气中氧气氧化,保存FeCl2溶液时加固体Fe,防止Fe2+被氧气氧化,故答案为:防止Fe2+被氧气氧化;
(4)E转化为F是氢氧化亚铁被氧气氧化生成氢氧化铁,现象是:白色沉淀迅速变成灰绿色,最后变成红褐色;反应化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,C→D反应离子方程式为:2Fe2++Cl2═2Fe3++2Cl-;故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3 ;2Fe2++Cl2=2Fe3++2Cl-。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案【题目】查阅资料:元素铬(Cr)在溶液中主要以Cr3+(蓝紫色) 、Cr(OH)4-(绿色) 、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
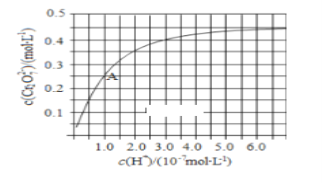
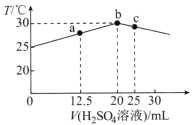
(1)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如右图所示。
①用离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性增大,CrO42的平衡转化率________(填“增大“减小”或“不变”)。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH____0(填“>”“<”或“=”)。
(2)欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去.已知:某含铬废水处理的主要流程如图所示:
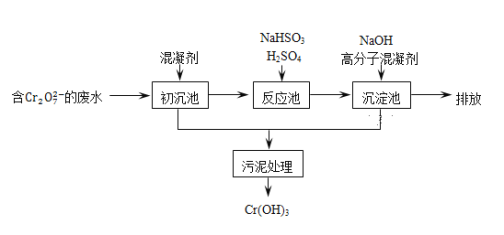
①初沉池中加入的混凝剂是K2SO4·Al2(SO4)3·24H2O,其作用为__________(用离子方程式表示).
②反应池中用NaHSO3将酸性废液中的Cr2O72-还原成Cr3+,该反应的离子方程式为________.根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子的先后顺序是____________。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.2 |
Cr3+ | 6.0 | 8.0 |
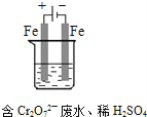
(3)工业可用电解法来处理含 Cr2O72-废水。实验室利用如图模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-═H2↑,Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是__________,得到的金属阳离子在阴极区可沉淀完全,用电解法处理该溶液中0.01mol Cr2O72-时,至少得到沉淀的质量是__________ g。