��Ŀ����
����Ŀ���������ķ�Ӧԭ�������������ȺϽ������Ϊ���缫�������������ߵ�ѹ���ò����绯ѧ��Ӧ���ѵ���ת��Ϊ��ѧ�ܣ����������������缫����������������������ͨ�����ۡ���������ԭ�������ֽ⽫��Ⱦ���ˮ���з��룬�Ӷ��ﵽ����ˮ���Ŀ�ġ�����˵����ȷ���ǣ� ��
A.�Ҽ�Ϊ��������Ϊ����
B.���Ӵ������Һ�����Ҽ�
C.ÿ����1 mol O2������������������ת�Ƶ�����Ϊ4NA
D.����Ϊ���������ڴ�����ˮ���������������ᷢ����4Fe2��+O2+4H+��4Fe3++2H2O
���𰸡�D
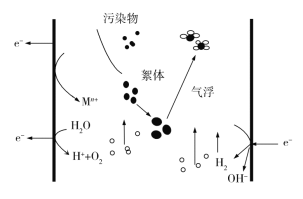
��������
��װ��ͼ��֪������Ϊ�������������缫����ʽ��Fe-2e-�TFe2+��2H2O-4e-�TO2��+4H+�����Ҷ����������ų������������������������ӷ���ʽΪ��4Fe2++O2+4H+�T4Fe3++2H2O�����������ӵõ��ӷ�����ԭ��Ӧ���缫��ӦʽΪ2H2O+2e-�TH2��+2OH-���ݴ˷������
A����װ���ǰѵ���ת��Ϊ��ѧ�ܵĵ��أ���������ĵ缫Ϊ���������������ĵ缫Ϊ������������Ϊ�������Ҽ�Ϊ��������A����
B�����Ӳ���ͨ���������Һ���������Һ��ͨ�����ӵĶ����ƶ�������������ʧ�����γɵ�������B����
C��ÿ����1 mol O2�����ݵ缫��Ӧ��Mne=Mn+��M������������2H2O4e=O2��+4H+��ת�Ƶ��ӵ����ʵ�������4 mol��ת�Ƶ���������4NA����C����
D���������⣬����Ϊ�������������缫��ӦʽΪFe2e=Fe2+��2H2O4e=O2��+4H+�����Ҷ����������ų������������������������ӷ���ʽΪ��4Fe2++O2+4H+�T4Fe3++2H2O����D��ȷ��
��ѡD��

����Ŀ����������:Ԫ�ظ�(Cr)����Һ����Ҫ��Cr3+(����ɫ) ��Cr(OH)4-(��ɫ) ��Cr2O72���Ⱥ�ɫ����CrO42����ɫ������ʽ���ڣ�Cr(OH)3Ϊ������ˮ�Ļ���ɫ���壬�ش��������⣺
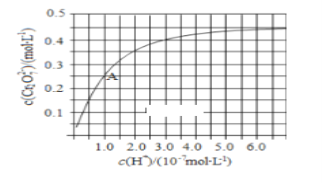
��1��CrO42��Cr2O72����Һ�п��ת���������£���ʼŨ��Ϊ1.0 mol��L1��Na2CrO4��Һ��c(Cr2O72)��c(H+)�ı仯����ͼ��ʾ��
�������ӷ���ʽ��ʾNa2CrO4��Һ�е�ת����Ӧ____________��
����ͼ��֪����Һ��������CrO42��ƽ��ת����________��������������С����������������
�������¶ȣ���Һ��CrO42��ƽ��ת���ʼ�С����÷�Ӧ����H____0������>����<������=������
��2�������ͷ�ˮ���ؽ���Ԫ�ظ��Ķ��ԣ��ɽ�Cr2O72-ת��ΪCr(OH)3������ȥ����֪��ij������ˮ��������Ҫ������ͼ��ʾ��
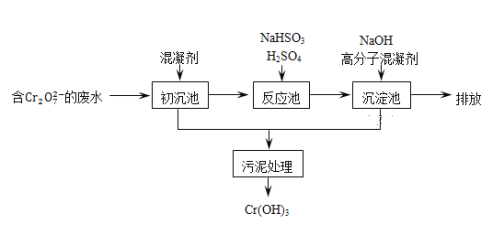
���������м���Ļ�������K2SO4��Al2(SO4)3��24H2O��������Ϊ__________�������ӷ���ʽ��ʾ����
����Ӧ������NaHSO3�����Է�Һ�е�Cr2O72-��ԭ��Cr3+���÷�Ӧ�����ӷ���ʽΪ________���������������������кͷ�����ԭ������������м���NaOH��Һ���˹����з�����Ҫ��Ӧ�����ӵ��Ⱥ�˳����____________��
�������↑ʼ����ʱ��pH | �������������ȫʱ��pH | |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.2 |
Cr3+ | 6.0 | 8.0 |
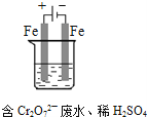
��3����ҵ���õ�ⷨ�������� Cr2O72-��ˮ��ʵ����������ͼģ�����Cr2O72-�ķ�ˮ��������Ӧʽ��Fe-2e-�TFe2+��������Ӧʽ��2H++2e-�TH2����Fe2+��������Һ�е�Cr2O72-��Ӧ�����ӷ���ʽ��__________���õ��Ľ������������������ɳ�����ȫ���õ�ⷨ��������Һ��0.01mol Cr2O72-ʱ�����ٵõ�������������__________ g��