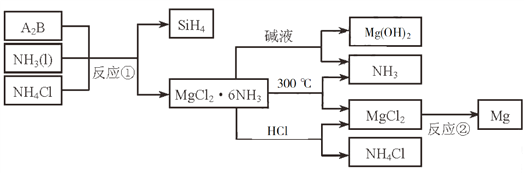
题目内容
【题目】实验室用如图所示装置制备氯气并进行一系列相关实验(夹持设备及必要的加热装置已省略)。
(1)整套装置装配完毕后,首先进行的操作是___,再添加试剂。
(2)实验室常用MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O制取氯气:
MnCl2+Cl2↑+2H2O制取氯气:
①实验时,通常采用密度为1.19g/cm3、浓度为36.5%的浓盐酸。该浓盐酸的物质的量浓度为____。
②标准状况下,上述反应每生成4.48L氯气,转移电子的物质的量为___mol。
(3)洗气装置B的作用是除去Cl2中的HCl气体,同时用作安全瓶(监测实验时装置C中是否发生堵塞)。若装置C发生堵塞,装置B中将观察到的现象是___。
(4)装置C的作用是验证氯气是否具有漂白性。为此,实验时装置C中I、II、III处依次放入的物质是____(填字母)。
A | B | C | D | |
I | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 无水氯化钙 | 无水氯化钙 | 浓硫酸 |
III | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 |
(5)向品红溶液中同时通入氯气和二氧化硫(按物质的量之比1:1),观察到的现象是___。用化学方程式解释一下原因___。
(6)F为尾气吸收装置。实验时,该装置中反应的离子方程式___。
【答案】检查装置的气密性 11.9mol/L 0.4mol 带支管的锥形瓶内液面下降,长颈漏斗内的液面上升 B 品红不褪色 Cl2+SO2+2H2O=2HCl+H2SO4 Cl2+2OH-=Cl-+ClO-+H2O
【解析】
装置A是实验室制取氯气的装置,二氧化锰和浓盐酸反应,纯净的氯气应除去氯气中的氯化氢,洗气装置B中的饱和食盐水是为了除去Cl2中的HCl气体,验证氯气是否具有漂白性,则先通过I中湿润的有色布条,观察到褪色,再利用II中固体干燥剂(无水氯化钙或硅胶)干燥后,在Ⅲ中放入干燥的有色布条,观察到颜色不褪,则验证氯气不具有漂白性。
(1)气体发生装置需要检查装置气密性;
(2)①实验时,通常采用密度为1.19g/cm3、浓度为36.5%的浓盐酸,该浓盐酸的物质的量浓度c=![]() ;
;
②利用化学方程式定量关系计算电子转移;
(3)浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度很小,所以B中饱和食盐水可以除去Cl2中的HCl;装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,装置C发生堵塞,则B中气体的压强增大,会导致带支管的锥形瓶内液面下降,长颈漏斗内的液面上升;
(4)装置C的实验目的是验证氯气是否具有漂白性,要验证干燥氯气无漂白性,需要先通过湿润的有色布条,然后干燥后接触湿润的有色布条,氯气和水反应生成次氯酸具有漂白性,据此分析;
(5)氯气和二氧化硫同时通入品红溶液中, 会发生氧化还原反应;
(6)过量的氯气会污染空气,尾气处理选择碱性物质氢氧化钠。
装置A是实验室制取氯气的装置,二氧化锰和浓盐酸反应,纯净的氯气应除去氯气中的氯化氢,洗气装置B中的饱和食盐水是为了除去Cl2中的HCl气体,验证氯气是否具有漂白性,则先通过I中湿润的有色布条,观察到褪色,再利用II中固体干燥剂(无水氯化钙或硅胶)干燥后,在Ⅲ中放入干燥的有色布条,观察到颜色不褪,则验证氯气不具有漂白性。
(1)整套装置装配完毕后,首先进行的操作是:检查装置的气密性,再添加试剂,
故答案为:检查装置的气密性;
(2)①实验时,通常采用密度为1.19g/cm3、浓度为36.5%的浓盐酸。该浓盐酸的物质的量浓度=![]() =
=![]() =11.9mol/L,
=11.9mol/L,
故答案为:11.9mol/L;
②标准状况下,上述反应每生成4.48L氯气,物质的量=![]() =0.2mol,MnO2+4HCl(浓)
=0.2mol,MnO2+4HCl(浓) ![]() MnC12+Cl2↑+2H2O:每生成1mol氯气,电子转移2mol,则生成0.2mol氯气电子的物质的量为0.4mol,
MnC12+Cl2↑+2H2O:每生成1mol氯气,电子转移2mol,则生成0.2mol氯气电子的物质的量为0.4mol,
故答案为:0.4mol;
(3)浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度很小,所以B中饱和食盐水可以除去Cl2中的HCl;装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的压强增大,带支管的锥形瓶内液面下降,长颈漏斗内的液面上升,B中长颈漏斗中液面上升,形成水柱,
故答案为:带支管的锥形瓶内液面下降,长颈漏斗内的液面上升;
(4)装置C的实验目的是验证氯气是否具有漂白性,要验证干燥氯气无漂白性,氯气接触湿润的有色布条,氯气和水反应生成次氯酸具有漂白性,选项中abc的Ⅱ中都是固体干燥剂,再通入湿润的有色布条不能验证氯气的漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选B,
故答案为B;
(5) 氯气和二氧化硫同时通入品红溶液中, 会发生氧化还原反应,品红不褪色,反应方程式为Cl2+SO2+2H2O=2HCl+H2SO4,
故答案为:Cl2+SO2+2H2O=2HCl+H2SO4;
(6)F为尾气吸收装置。实验时,该装置中反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O。

【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。供选试剂:30%H2O2溶液、0.1 mol/L H2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如下(请补充完整甲组实验仪器的名称。)

操 作 | 现 象 | |
甲 | 向Ⅰ的锥形瓶中加入MnO2,向Ⅰ的________中加入30%的H2O2溶液,连接Ⅰ、Ⅲ,打开活塞 | Ⅰ中产生无色气体并伴随大量的白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/LH2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是__________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是____________。为进一步探究该条件对反应速率的影响,可采取的实验措施是____________。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列_____________(填字母)溶液,证明了白雾中含有H2O2。
A.酸性 KMnO4 B. FeCl2 C. Na2S D.品红
(5)资料显示:KI溶液在空气中久置会被缓慢氧化:4KI+O2 +2H2O=2I2 +4KOH。该小组同学取20ml久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是:3I2+6OH-=5I-+IO3-+3H2O造成的。请设计实验证明他们的猜想是否正确:___。