题目内容
10.加入铝粉有氢气产生的溶液中,可能大量共存的离子组是( )| A. | Ba2+、Na+、I-、Fe3+ | B. | Mg2+、Cl-、NO3-、Al3+ | ||
| C. | K+、Cl-、HCO3-、SO42- | D. | Ba2+、Na+、Cl-、[Al(OH)4]- |
分析 加入铝粉有氢气产生的溶液,为非氧化酸或强碱溶液,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:加入铝粉有氢气产生的溶液,为非氧化酸或强碱溶液,
A.I-、Fe3+发生氧化还原反应,碱性溶液中不能大量存在Fe3+,不能大量共存,故A不选;
B.碱性溶液中不能大量存在Mg2+、Al3+,酸性溶液中Al、NO3-、H+发生氧化还原反应不生成氢气,故B不选;
C.HCO3-与酸、碱均反应,不能大量共存,故C不选;
D.碱性溶液中该组离子之间不反应,可大量共存,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
20.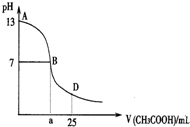 下图为向25mL 0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与
下图为向25mL 0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与
c(CH3COO-)大小关系是( )
 下图为向25mL 0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与
下图为向25mL 0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是( )
| A. | c(OH-)一定大于c(CH3COO-) | B. | c(OH-)一定小于c(CH3COO-) | ||
| C. | c(OH-)一定等于c(CH3COO-) | D. | c(OH-)大于、小于或等于c(CH3COO-) |
1.下列说法中正确的是( )
| A. | 饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大 | |
| B. | AgCl悬浊液中存在平衡:AgCl(s)═Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小 | |
| C. | AgCl悬浊液中加入KI溶液,白色沉淀变成黄色,证明此条件下Ksp(AgCl)>Ksp(AgI) | |
| D. | 硬水中含有较多的Ca2+?Mg2+?HCO3-、SO42-,加热煮沸可以完全除去其中的Ca2+?Mg2+ |
18.用酸性氢氧燃料电池(甲池)为电源进行电解的实验装置(乙池,一定条件下可实现有机物的电化学储氢)如图所示.甲池中C为含苯的物质的量分数为10%的混合气体,D为l0mol混合气体其中苯的物质的量分数为24%(杂质不参与反应),E为标准状况下2.8mol气体(忽略水蒸汽),下列说法正确的是( )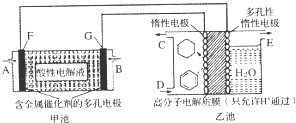

| A. | 甲池中A处通入H2,E处有O2放出 | B. | 甲池中H+由F极移向G极 | ||
| C. | 乙池中阴极区只有苯被还原 | D. | 导线中共传导11.2mol电子 |
5.下列有关电解质溶液的说法正确的是( )
| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| B. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| C. | 在Na2C2O4稀溶液中,c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| D. | 0.1 mol/L Na2CO3溶液与0.1 mol/L NaHCO3溶液等体积混合:3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] |
2.下列图示的实验操作不能实现相应实验目的是( )
| A. |  证明装置的气密性良好 | |
| B. | 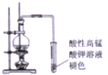 证明乙醇与浓H2SO4共热生成了大量乙烯 | |
| C. |  证明SO2有还原性 | |
| D. |  用饱和食盐水与CaC2制备并收集C2H2 |
