题目内容
8.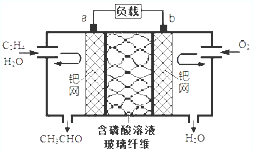 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,下列说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,下列说法正确的是( )| A. | 每有0.1mol O2反应,则迁移H+0.4mol | |
| B. | 正极反应式为:CH2=CH2-2e-+2OH-=CH3CHO+H2O | |
| C. | 电子移动方向:电极a→磷酸溶液→电极b | |
| D. | 该电池为可充电电池 |
分析 该燃料电池中,放电时,通入乙烯的电极是负极、通入氧气的电极是正极,电解质溶液呈酸性,负极反应式为CH2=CH2-2e-+H2O=CH3CHO+2H+,正极反应式为O2+4H++4e-═2H2O,电子从负极沿导线流向正极,据此分析解答.
解答 解:A.根据O2+4H++4e-═2H2O知,每有0.1mol O2反应,则迁移H+0.4mol,故A正确;
B.正极上氧气得电子发生还原反应,电极反应式为O2+4H++4e-═2H2O,故B错误;
C.放电时电子从负极a沿导线流向正极b,电子不进入电解质溶液,电解质溶液中阴阳离子定向移动形成电流,故C错误;
D.充电时,不能生成乙烯和氧气,不是充电电池,故A错误;
故选A.
点评 本题考查化学电源新型电池,会正确书写电极反应式是解本题关键,为高考高频点,易错选项是C,注意电子不进入电解质溶液,知道电解质溶液导电原理.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
18.下列有关实验说法正确的是( )
| A. | 在进行中和滴定时,用标准酸溶液润洗酸式滴定管2~3次,用蒸馏水洗2~3次,效果更佳 | |
| B. | 基于硫代硫酸钠与稀硫酸反应生成S和SO2,在定量分析测定反应速率时,即可用S对标记遮盖发,也可用排水法测SO2体积,计算出相关的反应速率 | |
| C. | 燃料电池的制作:用包有薄海绵的两根碳棒做电极电解NaSO4溶液,一段时间后切断电源,在两极之间接上发光二极管,发现二极管发光 | |
| D. | 过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离混合物的方法 |
16.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 71gNa2SO4固体中含钠离子数目为NA | |
| B. | 28g由乙烯和丙烯组成的混合气体中含碳碳双键数目为NA | |
| C. | 标准状况下,22.4LHF中含HF分子数目为NA | |
| D. | 25g质量分数为68%的H2O2水溶液中含氧原子数目为NA |
13.下述实验能达到预期实验目的是( )
| 序号 | 实验内容 | 实验目的 |
| A | 向盛有10滴0.1 mol•L-1AgNO3溶液的试管中滴加0.1mol•L-1 NaCl溶液,至不再有沉淀生成,再向其中滴加0.1mol•L-1 Na2S溶液 | 证明AgCl能转化为溶解度更小的Ag2S |
| B | 取某溶液少量,加入盐酸酸化的氯化钡溶液,出现白色沉淀 | 证明该溶液中一定含有大量的SO42- |
| C | 向某卤代烃中加入NaOH溶液,加热一段时间后,加入AgNO3溶液 | 检验卤代烃中的卤素原子 |
| D | 向纯碱中滴加足量盐酸,将产生的气体通入苯酚钠溶液 | 证明酸性:盐酸>碳酸>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
20.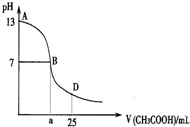 下图为向25mL 0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与
下图为向25mL 0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与
c(CH3COO-)大小关系是( )
 下图为向25mL 0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与
下图为向25mL 0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是( )
| A. | c(OH-)一定大于c(CH3COO-) | B. | c(OH-)一定小于c(CH3COO-) | ||
| C. | c(OH-)一定等于c(CH3COO-) | D. | c(OH-)大于、小于或等于c(CH3COO-) |
17.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 最高价氧化物对应水化物的碱性:C>D | |
| C. | 化合物AE与CE具有不同类型的化学键 | |
| D. | 一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应 |
18.用酸性氢氧燃料电池(甲池)为电源进行电解的实验装置(乙池,一定条件下可实现有机物的电化学储氢)如图所示.甲池中C为含苯的物质的量分数为10%的混合气体,D为l0mol混合气体其中苯的物质的量分数为24%(杂质不参与反应),E为标准状况下2.8mol气体(忽略水蒸汽),下列说法正确的是( )

| A. | 甲池中A处通入H2,E处有O2放出 | B. | 甲池中H+由F极移向G极 | ||
| C. | 乙池中阴极区只有苯被还原 | D. | 导线中共传导11.2mol电子 |
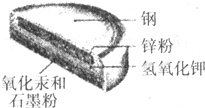 某种钮扣电池的剖面结构如图所示.请回答下列问题:
某种钮扣电池的剖面结构如图所示.请回答下列问题:
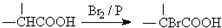
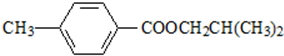 .
.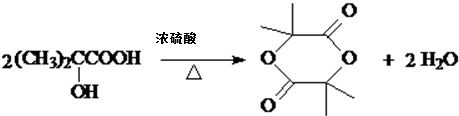 ,该反应属于取代反应(或酯化反应)(填反应类型).
,该反应属于取代反应(或酯化反应)(填反应类型).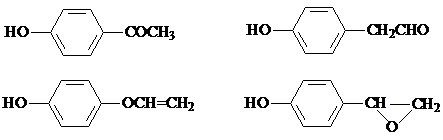 .
.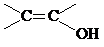 )结构.
)结构.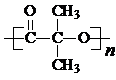 .
.