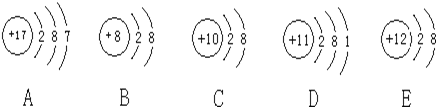
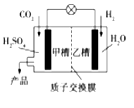
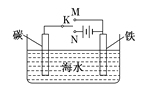
题目内容
【题目】700℃时,H2(g)+CO2(g)![]() H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v (H2O)为0.025 mol/(L·min),下列判断不正确的是( )
H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v (H2O)为0.025 mol/(L·min),下列判断不正确的是( )
起始浓度 | 甲 | 乙 | 丙 |
C(H2)/mol/L | 0.1 | 0.2 | 0.2 |
C(CO2)/mol/L | 0.1 | 0.1 | 0.2 |
A. 平衡时,乙中CO2的转化率大于50%
B. 当反应平衡时,丙中c(CO2)是甲中的2倍
C. 温度升至800℃,上述反应平衡常数为25/16,则正反应为吸热反应
D. 其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/L CO2,到达平衡时c (CO)与乙不同
【答案】D
【解析】A、甲装置中生成H2O的物质的量浓度为0.025×2mol·L-1=0.05mol·L-1,因此消耗CO2物质的量浓度为0.05mol·L-1,则CO2的转化率为0.05/0.1×100%=50%,乙装置相当于在甲的基础上增加0.1mol·L-1的H2,平衡向正反应方向移动,CO2的转化率增大,即乙中CO2的转化率大于50%,故A说法正确;B、根据化学反应方程式,反应前后气体系数之和相等,因此甲和丙为等效平衡,丙装置中c(CO2)是甲中2倍,故B说法正确;C、
H2(g)+CO2(g)![]() H2O(g)+CO(g)
H2O(g)+CO(g)
起始: 0.1 0.1 0 0
变化: 0.05 0.05 0.05 0.05
平衡: 0.05 0.05 0.05 0.05 根据化学平衡常数的表达式,700℃时的化学平衡常数为0.05×0.05/(0.05×0.05)=1<25/16,说明升高温度,平衡向正反应方向移动,根据勒夏特列原理,正反应方向为吸热反应,故C说法正确;D、因为反应前后气体系数之和相等,因此两个平衡中c(CO)相同,故D说法错误。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】2SO2(g)+ O2(g) ![]() 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断正确的是
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断正确的是
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率/% | 80 | α1 | α2 |
A. 甲中反应的平衡常数小于乙
B. 该温度下,平衡常数值为400
C. 平衡时,丙中c(SO3)是甲中的2倍
D. 平衡时,甲中O2的转化率大于乙中O2的转化率