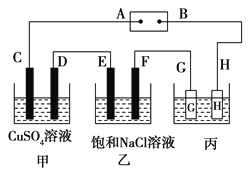
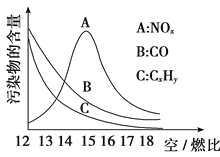
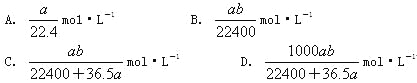题目内容
【题目】将表面已部分被氧化为氧化钠的金属钠样品5.4g放入40g水中,在标准状况下放出1.12LH2 。求:
(1)样品中金属钠的质量为____________克.
(2)若反应后溶液的体积为40mL,所得溶液的物质的量浓度为_______mol/L
【答案】2.3g 5mol/L
【解析】
(1)根据反应2Na+2H2O=2NaOH+H2↑计算;
(2)根据总质量分别计算Na和Na2O的物质的量,进而计算生成NaOH的总物质的量,可求得浓度。
(1) 2Na+2H2O=2NaOH+H2↑
46g 1mol
m(Na) 0.05mol
m(Na)=![]() =2.3g,
=2.3g,
答:原混合物中金属钠的质量为2.3g。
(2)原混合物中金属钠的质量为2.3g,则m(Na2O)=5.4g-2.3g=3.1g,n(Na)=![]() =0.1mol,
=0.1mol,
n(Na2O)=![]() =0.05mol,
=0.05mol,
则与水反应生成的总NaOH的物质的量为:n(NaOH)=0.1mol+0.05mol×2=0.2mol,c(NaOH)=![]() =5mol/L,
=5mol/L,
答:所得溶液的物质的量浓度为5mol/L。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】700℃时,H2(g)+CO2(g)![]() H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v (H2O)为0.025 mol/(L·min),下列判断不正确的是( )
H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v (H2O)为0.025 mol/(L·min),下列判断不正确的是( )
起始浓度 | 甲 | 乙 | 丙 |
C(H2)/mol/L | 0.1 | 0.2 | 0.2 |
C(CO2)/mol/L | 0.1 | 0.1 | 0.2 |
A. 平衡时,乙中CO2的转化率大于50%
B. 当反应平衡时,丙中c(CO2)是甲中的2倍
C. 温度升至800℃,上述反应平衡常数为25/16,则正反应为吸热反应
D. 其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/L CO2,到达平衡时c (CO)与乙不同