��Ŀ����
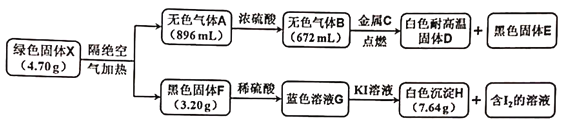
����Ŀ��±��Ԫ���Ƿǽ����Ժ�ǿ��һ��Ԫ�أ����γɶ������ʡ�
(1)���������������ֻ�ԭ��,ͬʱ���ʵ��������ֿɷ�������������ԭ��Ӧ��
�ٽ�����������ͨ�뵽H2S��Һ�У��������õ���Һ�м����������ữ��BaCl2��Һ�ɵõ���ɫ����,д��ǰһ����Ӧ�����ӷ���ʽ��____________________________��
�ڽ�0.1molCl2����ͨ�뵽amL��Ũ��Ϊ2mol/L��KOH��Һ�У�����ǡ�÷�Ӧ��,�����Һc(ClO-)��c(ClO3-)��c(Cl-)=2��1��7,��a=______________��
(2)KClO3��һ����Ҫ��������,��ҵ���Ʊ�KClO3�ķ���֮һ���£�
![]()
��д�����ʱ��Ӧ�Ļ�ѧ����ʽ��_______________________________��
����ͬ�¶���,���������ε��ܽ����Դ�С��NaClO3___________KClO3(�>����<��)��
��KClO3��MnO2�Ĵ������¼��ȷֽ����������ķ�Ӧ�������£�����д�հ״���
2KClO3+2MnO2![]() 2KMnO4+Cl2��+O2��;
2KMnO4+Cl2��+O2��;
2KMnO4![]() K2MnO4+MnO2+O2����
K2MnO4+MnO2+O2����
K2MnO4+Cl2![]() O2��+___________+___________��
O2��+___________+___________��
��Ӧ��������������뿪����Ҫ������__________________________��
(3)��֪Cl2O������������,��Cl2Oͨ�뵽ˮ�пɵõ�һ��������Һ����д������Һ���еij��������һ�ֻ�ѧ����______________������������ͨ�뵽NaOH��Һ��ǡ����ȫ��Ӧ,����Һ�и�����Ũ���ɴ�С��˳��Ϊ______________________��
���𰸡�4Cl2+H2S+4H2O=10H++SO42-+8Cl-100NaCl+3H2O![]() NaClO3+3H2>2KClMnO2�ܽ⡢���ˡ�ϴ�ӡ������ᾧƯ���Ի�ǿ�����Ե�c(Na+)>c(ClO-)>c(OH-)>c(H+)
NaClO3+3H2>2KClMnO2�ܽ⡢���ˡ�ϴ�ӡ������ᾧƯ���Ի�ǿ�����Ե�c(Na+)>c(ClO-)>c(OH-)>c(H+)
��������
(1)���������õ���Һ�м����������ữ��BaCl2��Һ�ɵõ���ɫ����������Һ����SO42-���ɣ��ʴ�Ϊ��4Cl2+H2S+4H2O=10H++SO42-+8Cl-�����ɷ�Ӧ��������Ԫ�ظ���Ԫ�ص������غ�ɵù�ϵʽ��Cl2~2KOH������a��10-3L��2mol/L=0.1mol��2��a=100���ʴ�Ϊ100��
(2)����Ϊ��������û�и�Ĥ���ʵ���������������NaOH��Ӧ����NaClO3���ʴ�ΪNaCl+3H2O![]() NaClO3+3H2��������NaClO3����KCl��������KClO3���壬�ɸ��ֽⷴӦ���ɿ�֪KClO3���ܽ�ȸ�С���ʴ�Ϊ��>����KClO3��MnO2�Ĵ������¼��ȷֽ������������ܷ�ӦΪ��2KClO3
NaClO3+3H2��������NaClO3����KCl��������KClO3���壬�ɸ��ֽⷴӦ���ɿ�֪KClO3���ܽ�ȸ�С���ʴ�Ϊ��>����KClO3��MnO2�Ĵ������¼��ȷֽ������������ܷ�ӦΪ��2KClO3![]() 2KCl+3O2������Ϸ�Ӧ���̿�֪��ӦK2MnO4+Cl2
2KCl+3O2������Ϸ�Ӧ���̿�֪��ӦK2MnO4+Cl2![]() O2��+2 KCl+MnO2����Ӧ�������������Ҫ��KCl��MnO2��MnO2Ϊ������ˮ�Ĺ��壬������ӵIJ���Ϊ���ܽ⡢���ˡ�ϴ�ӡ������ᾧ���ʴ�Ϊ��2KCl��MnO2���ܽ⡢���ˡ�ϴ�ӡ������ᾧ��(3) Cl2O������������Ǵ���������������뷴Ӧ���ɵĴ��������ǿ�����ԣ���NaOH��Һ��ǡ����ȫ��Ӧ�����ɵ���NaClO����������ǿ���Σ���Һ�ʼ��ԣ�����Һ������Ũ�ȵĴ�С��ϵΪ��c(Na+)>c(ClO-)>c(OH-)>c(H+)���ʴ�Ϊ: Ư���Ի�ǿ�����Եȡ�c(Na+)>c(ClO-)>c(OH-)>c(H+)��
O2��+2 KCl+MnO2����Ӧ�������������Ҫ��KCl��MnO2��MnO2Ϊ������ˮ�Ĺ��壬������ӵIJ���Ϊ���ܽ⡢���ˡ�ϴ�ӡ������ᾧ���ʴ�Ϊ��2KCl��MnO2���ܽ⡢���ˡ�ϴ�ӡ������ᾧ��(3) Cl2O������������Ǵ���������������뷴Ӧ���ɵĴ��������ǿ�����ԣ���NaOH��Һ��ǡ����ȫ��Ӧ�����ɵ���NaClO����������ǿ���Σ���Һ�ʼ��ԣ�����Һ������Ũ�ȵĴ�С��ϵΪ��c(Na+)>c(ClO-)>c(OH-)>c(H+)���ʴ�Ϊ: Ư���Ի�ǿ�����Եȡ�c(Na+)>c(ClO-)>c(OH-)>c(H+)��

����Ŀ���������ҹ��������������������2.5�����µ�ϸ������(PM2.5)�ǵ�������������������������������е�CO��SO2�������������Ⱦ�����ͨ��������ѧ��Ӧ����PM2.5�����
��1�� ��CaSO4����O2��ȼ��CO��Ӧ����һ�ָ�Ч����ࡢ���õ�����ȼ�ռ������ȿ����ȼ��Ч�ʣ����ܵõ��ϴ���CO2���Ա��ڱ���������Ӧ��Ϊ����Ӧ����Ӧ�ں͢�Ϊ����Ӧ��
����CaSO4(s)��4CO(g)==CaS(s)��4CO2(g) ��H1����189.2 kJ��mol-1
����CaSO4(s)��CO(g)==CaO(s)��CO2(g)��SO2(g)�� ��H2����210.5 kJ��mol-1
����CO(g)==![]() C(s)��
C(s)��![]() CO2(g) ��H3����86.2 kJ��mol-1
CO2(g) ��H3����86.2 kJ��mol-1
��Ӧ2CaSO4(s)��7CO(g)==CaS(s)��CaO(s)��6CO2(g)��C(s)��SO2(g)����H��_________________
��2����֪��CO����CO2�Ļ�ѧ����ʽΪCO��O2![]() CO2��O��������Ӧ����Ϊv��=K����c(CO) ��c(O2)���淴Ӧ����Ϊv��=K����c(CO2) ��c(O)��K����K��Ϊ���ʳ�������2500 K����K��=1.21��105 L��s-1��mol-1��K��=3.02��105 L��s-1��mol-1������¶���������Ӧ��ƽ�ⳣ��KֵΪ________(����С�����һλС��)��
CO2��O��������Ӧ����Ϊv��=K����c(CO) ��c(O2)���淴Ӧ����Ϊv��=K����c(CO2) ��c(O)��K����K��Ϊ���ʳ�������2500 K����K��=1.21��105 L��s-1��mol-1��K��=3.02��105 L��s-1��mol-1������¶���������Ӧ��ƽ�ⳣ��KֵΪ________(����С�����һλС��)��
��3���û���̿��ԭ�����Դ����������ij�о�С����ij�ܱ������м���һ�����Ļ���̿��NO��������Ӧ��C(s)��2NO(g)![]() N2(g)��CO2(g)����H=Q kJ��mol-1����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
N2(g)��CO2(g)����H=Q kJ��mol-1����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
ʱ��(min) Ũ��(mol��L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
��0��10 min�ڣ�NO��ƽ����Ӧ����v(NO)=___________________________________��
��30 min��ֻ�ı�ijһ��������Ӧ����ƽ�⣬�����ϱ������жϸı������������____(ѡ����ĸ)��
a������һ�����Ļ���̿ b��ͨ��һ������NO c���ʵ���С��������� d��������ʵĴ���
����30min�������¶���T2�����ﵽƽ��ʱ��������NO��N2��CO2��Ũ��֮��Ϊ5��3��3����Q_____0 (������������������������)��
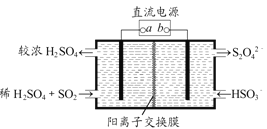
��4��������ͼ��ʾ���װ��(�缫��Ϊ���Ե缫)Ҳ������SO2�������������ų�����Һ����NO2�����Դb�����ӵĵ缫�ĵ缫��ӦʽΪ____________________________________��
��5��NO2��һ�������¿�ת��ΪNH4NO3��NH4NO2����ͬ�¶�������Ũ��NH4NO3��NH4NO2������Һ�����NH4NO2��Һ��c(NH4+)��С���������ܵ�ԭ��________________________��
����Ŀ��700��ʱ��H2��g����CO2��g��![]() H2O��g����CO��g�������¶��£��ڼס��ҡ������������ܱ������У�Ͷ��H2��CO2����ʼŨ�����±���ʾ�����м�2min��ƽ��ʱ��v (H2O)Ϊ0.025 mol/��L��min���������жϲ���ȷ���ǣ� ��
H2O��g����CO��g�������¶��£��ڼס��ҡ������������ܱ������У�Ͷ��H2��CO2����ʼŨ�����±���ʾ�����м�2min��ƽ��ʱ��v (H2O)Ϊ0.025 mol/��L��min���������жϲ���ȷ���ǣ� ��
��ʼŨ�� | �� | �� | �� |
C��H2��/mol/L | 0.1 | 0.2 | 0.2 |
C��CO2��/mol/L | 0.1 | 0.1 | 0.2 |
A. ƽ��ʱ������CO2��ת���ʴ���50��
B. ����Ӧƽ��ʱ������c��CO2���Ǽ��е�2��
C. �¶�����800�棬������Ӧƽ�ⳣ��Ϊ25/16��������ӦΪ���ȷ�Ӧ
D. �����������䣬����ʼʱ���������г���0.10mol/L H2��0.20 mol/L CO2������ƽ��ʱc (CO)���Ҳ�ͬ