题目内容
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)SiO2是玻璃的成分之一,SiO2与氢氧化钠溶液反应的化学方程式为______________________________,工艺师常用________(填物质名称)来雕刻玻璃。
(2)用Na2SiO3溶液浸泡过的棉花不易燃烧,体现Na2SiO3的用途可作________的原料。
(3)工业上常用2C+SiO2![]() Si+2CO↑制备硅单质,该反应中有元素化合价升高的物质是________(填化学式,下同),氧化剂是________。
Si+2CO↑制备硅单质,该反应中有元素化合价升高的物质是________(填化学式,下同),氧化剂是________。
【答案】 (1)SiO2+2NaOH===Na2SiO3+H2O 氢氟酸
(2)防火剂 (3)C SiO2
【解析】 (1)SiO2与NaOH溶液反应的化学方程式为:
SiO2+2NaOH===Na2SiO3+H2O。由于SiO2能溶于氢氟酸,因此工艺师常用氢氟酸来雕刻玻璃。
(2)Na2SiO3的水溶液又称“水玻璃”,它具有阻燃的功能,因此可作防火剂。
(3)反应中C被氧化,SiO2中的+4价的硅被还原,因此SiO2作氧化剂。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】近几年我国大面积发生雾霾天气,2.5微米以下的细颗粒物(PM2.5)是导致雾霾天气的“罪魁祸首”。空气中的CO、SO2、氮氧化物等污染气体会通过大气化学反应生成PM2.5颗粒物。
(1) 用CaSO4代替O2与燃料CO反应,是一种高效、清洁、经济的新型燃烧技术,既可提高燃烧效率,又能得到较纯的CO2,以便于被处理。反应①为主反应,反应②和③为副反应。
ⅰ.CaSO4(s)+4CO(g)==CaS(s)+4CO2(g) ΔH1=-189.2 kJ·mol-1
ⅱ.CaSO4(s)+CO(g)==CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5 kJ·mol-1
ⅲ.CO(g)==![]() C(s)+
C(s)+![]() CO2(g) ΔH3=-86.2 kJ·mol-1
CO2(g) ΔH3=-86.2 kJ·mol-1
反应2CaSO4(s)+7CO(g)==CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的ΔH=_________________
(2)已知由CO生成CO2的化学方程式为CO+O2![]() CO2+O。其正反应速率为v正=K正·c(CO) ·c(O2),逆反应速率为v逆=K逆·c(CO2) ·c(O),K正、K逆为速率常数。在2500 K下,K正=1.21×105 L·s-1·mol-1,K逆=3.02×105 L·s-1·mol-1。则该温度下上述反应的平衡常数K值为________(保留小数点后一位小数)。
CO2+O。其正反应速率为v正=K正·c(CO) ·c(O2),逆反应速率为v逆=K逆·c(CO2) ·c(O),K正、K逆为速率常数。在2500 K下,K正=1.21×105 L·s-1·mol-1,K逆=3.02×105 L·s-1·mol-1。则该温度下上述反应的平衡常数K值为________(保留小数点后一位小数)。
(3)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) ΔH=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10 min内,NO的平均反应速率v(NO)=___________________________________;
②30 min后只改变某一条件,反应达新平衡,根据上表数据判断改变的条件可能是____(选填字母);
a.加入一定量的活性炭 b.通入一定量的NO c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5∶3∶3,则Q_____0 (填“>”、“=”或“<”)。
(4)利用如图所示电解装置(电极均为惰性电极)也可吸收SO2,并用阴极室排出的溶液吸收NO2。与电源b极连接的电极的电极反应式为____________________________________。
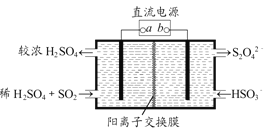
(5)NO2在一定条件下可转化为NH4NO3和NH4NO2。相同温度下,等浓度NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH4+)较小,分析可能的原因________________________。
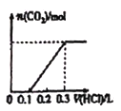
【题目】700℃时,H2(g)+CO2(g)![]() H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v (H2O)为0.025 mol/(L·min),下列判断不正确的是( )
H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v (H2O)为0.025 mol/(L·min),下列判断不正确的是( )
起始浓度 | 甲 | 乙 | 丙 |
C(H2)/mol/L | 0.1 | 0.2 | 0.2 |
C(CO2)/mol/L | 0.1 | 0.1 | 0.2 |
A. 平衡时,乙中CO2的转化率大于50%
B. 当反应平衡时,丙中c(CO2)是甲中的2倍
C. 温度升至800℃,上述反应平衡常数为25/16,则正反应为吸热反应
D. 其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/L CO2,到达平衡时c (CO)与乙不同