题目内容
10.下列说法正确的是( )| A. | 0.1 mol•L-1的醋酸加水稀释,$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 | |
| B. | 体积、pH均相同的醋酸和盐酸完会溶解等量的镁粉(少量),后者用时少 | |
| C. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大 | |
| D. | 常温下,V1 L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
分析 A.醋酸加水稀释c(H+)减小,c(OH-)增大;
B.体积、pH均相同的醋酸和盐酸,醋酸的浓度大于盐酸;
C.Kw只与温度有关;
D.如HA为强酸,则V1=V2,如HA为弱酸,HA的浓度较大.
解答 解:A.醋酸加水稀释c(H+)减小,c(OH-)增大,则$\frac{c({H}^{+})}{c(O{H}^{-})}$减小,故A正确;
B.醋酸为弱电解质,体积、pH均相同的醋酸和盐酸,醋酸的浓度大于盐酸,则醋酸与Zn反应的速率大,用时少,故B错误;
C.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw只受温度的影响,则Kw不变,故C错误;
D.如HA为强酸,则V1=V2,如HA为弱酸,HA的浓度较大,则V1>V2,故D错误.
故选A.
点评 本题综合考查弱电解质的电离以及平衡移动的影响因素,注意弱酸溶液在稀释时溶液中离子浓度的变化,题目难度中等.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
14.下列实验操作能达到预期实验目的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 检验Fe2(SO4)3溶液中是否含有FeSO4 | 取少量溶液于试管,加入几滴0.1mol/L KMnO4溶液 |
| B | 证明Al(OH)3是两性氢氧化物 | 取Al(OH)3于试管A、B,分别滴加氨水与盐酸 |
| C | 使蛋白质能变性 | 向鸡蛋清溶液中,加入饱和(NH4)2SO4溶液,产生沉淀 |
| D | 除去Na2CO3中的NaCl | 溶解,加入AgNO3溶液至不再产生沉淀,静置,过滤 |
| A. | A | B. | B | C. | C | D. | D |
15.下列物质一定属于同系物的是( )
①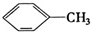 ②
②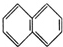 ③
③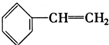 ④C2H4⑤CH2═CH-CH═CH2⑥C3H6
④C2H4⑤CH2═CH-CH═CH2⑥C3H6
⑦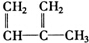 ⑧
⑧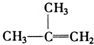
①
 ②
② ③
③ ④C2H4⑤CH2═CH-CH═CH2⑥C3H6
④C2H4⑤CH2═CH-CH═CH2⑥C3H6⑦
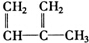 ⑧
⑧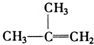
| A. | ①和 ② | B. | ④和⑥ | C. | ⑤和⑦ | D. | ⑦和⑧ |
19.某研究性学习小组做铜与浓硫酸反应实验时,发现试管底部有白色固体甲并夹杂有少量黑色物质乙.倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,发现所得溶液为蓝色,仍有未溶解的黑色固体丙.过滤、洗涤后,向黑色固体丙中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,所得溶液加BaCl2溶液后有白色沉淀生成.下列所得结论不正确的是( )
| A. | 铜与浓硫酸反应所得白色固体甲是CuSO4 | |
| B. | 加BaCl2溶液后所得白色沉淀是BaSO3 | |
| C. | 白色固体甲中夹杂的少量黑色物质乙中不可能含有CuO | |
| D. | 白色固体甲中夹杂的少量黑色物质乙中含元素Cu、S |
20.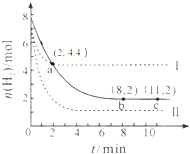 某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如右图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )
某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如右图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )
 某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如右图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )
某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如右图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )| A. | 曲线Ⅰ对应的条件改变可能降低温度 | |
| B. | 曲线Ⅱ对应的条件改变可能是充入氦气 | |
| C. | 该温度下,此反应的化学平衡常数的数值为0.5 | |
| D. | 从反应开始至a 点,ν(CO2)=0.6 mol•L-1•min-1 |
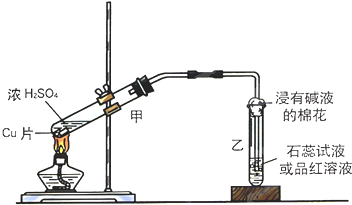 实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.
实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.
 X、Y是元素周期表前20号元素,且X的原子序数比Y大4,请填空(X、Y要用具体的元素符号表示):
X、Y是元素周期表前20号元素,且X的原子序数比Y大4,请填空(X、Y要用具体的元素符号表示):