题目内容
3.据报道,科学家发现了如下反应:O2+PtF6=O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列说法正确的是( )| A. | O2(PtF6)晶体中含有离子键 | |
| B. | O2(PtF6)中氧元素的化合价为+1价 | |
| C. | 在此反应中,O2是氧化剂,PtF6是还原剂 | |
| D. | 反应中,每生成1mol O2(PtF6)转移1mol电子 |
分析 A.O2(PtF6) 为离子化合物,则一定含有离子键;
B.O2(PtF6) 中Pt为+5价,根据化合价代数和为0计算氧元素的化合价;
C.根据O元素的化合价升高是还原剂,Pt元素的化合价降低是氧化剂判断;
D.根据每生成1mol O2(PtF6),由Pt的化合价变化可知,转移1mol×(6-5)=1mol电子;
解答 解:O2(PtF6)为离子化合物,其中Pt为+5价,则O2+PtF6→O2(PtF6)中,O元素的化合价升高,Pt元素的化合价降低,
A.O2(PtF6) 为离子化合物,所以一定含有离子键,故A正确;
B.O2(PtF6) 中Pt为+5价,根据化合价代数和为0,则氧元素的化合价是+0.5价,故B错误;
C.在此反应中,O元素的化合价升高,O2是还原剂,Pt元素的化合价降低,PtF6是氧化剂,故C错误;
D.此反应中,每生成1mol O2(PtF6),由Pt的化合价变化可知,转移1mol×(6-5)=1mol 电子,故D正确;
故选:AD.
点评 本题考查氧化还原反应,明确元素的化合价变化是解答本题的关键,注意O2作为整体来考虑,O元素的化合价升高,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.化学与社会、生活密切相关,下列有关说法中正确的是( )
| A. | 燃煤中加入CaO后可减少温室气体的排放量 | |
| B. | 糖类、油脂、蛋白质都是人类重要的营养物质,均属于天然高分子化合物 | |
| C. | 漂白粉、明矾均可用于饮用水处理,其化学原理相同 | |
| D. | 在全球每年被腐蚀的金属中,电化学腐蚀比化学腐蚀所占比例高 |
14.下列实验操作能达到预期实验目的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 检验Fe2(SO4)3溶液中是否含有FeSO4 | 取少量溶液于试管,加入几滴0.1mol/L KMnO4溶液 |
| B | 证明Al(OH)3是两性氢氧化物 | 取Al(OH)3于试管A、B,分别滴加氨水与盐酸 |
| C | 使蛋白质能变性 | 向鸡蛋清溶液中,加入饱和(NH4)2SO4溶液,产生沉淀 |
| D | 除去Na2CO3中的NaCl | 溶解,加入AgNO3溶液至不再产生沉淀,静置,过滤 |
| A. | A | B. | B | C. | C | D. | D |
11.下列有关制取溴苯的实验描述正确的是( )
| A. | 在苯和液溴的混合物中,添加少量铁屑后马上剧烈反应 | |
| B. | 伸出烧瓶的导管要有足够长度,其作用是导出气体和充分冷凝回流逸出的苯和溴蒸气 | |
| C. | 导管末端应插入锥形瓶内水面以下,有利于HBr气体被吸收 | |
| D. | 反应后烧瓶中是褐色的油状液体,倒入盛有足量浓烧碱溶液的分液漏斗中,充分振荡后静置,上层液体是无色的溴苯 |
18.NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 78gNa2O2与62gNa2O中所含阴离子数目都是NA | |
| B. | 常温常压下,NA个Cl2通入水中,转移电子数为NA | |
| C. | 电解精炼铜时,若阴极得到2NA个电子,则阳极质量减少64g | |
| D. | 5.6g铁粉与足量硫粉充分反应,转移电子数为0.3NA |
19.某研究性学习小组做铜与浓硫酸反应实验时,发现试管底部有白色固体甲并夹杂有少量黑色物质乙.倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,发现所得溶液为蓝色,仍有未溶解的黑色固体丙.过滤、洗涤后,向黑色固体丙中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,所得溶液加BaCl2溶液后有白色沉淀生成.下列所得结论不正确的是( )
| A. | 铜与浓硫酸反应所得白色固体甲是CuSO4 | |
| B. | 加BaCl2溶液后所得白色沉淀是BaSO3 | |
| C. | 白色固体甲中夹杂的少量黑色物质乙中不可能含有CuO | |
| D. | 白色固体甲中夹杂的少量黑色物质乙中含元素Cu、S |
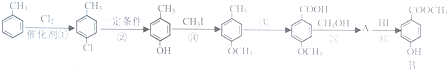
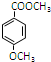 ,反应③的反应类型为取代反应.
,反应③的反应类型为取代反应.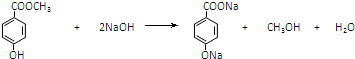 .
.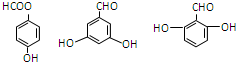 .
.
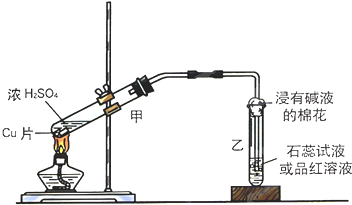 实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.
实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.