��Ŀ����
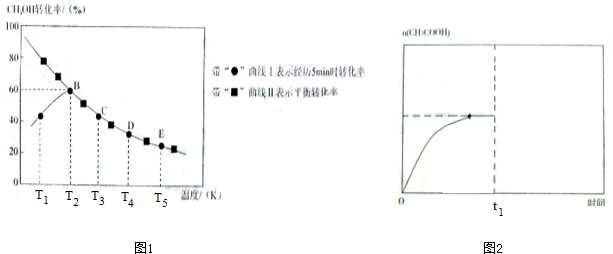
7����������Ҫ���л�����ԭ��֮һ��Ŀǰ������һ�����ϵ����ᶼ���ü״���CO��Ӧ���Ʊ���ijʵ��С����һ����ѹ�ܱ������м���0.20molCH3OH��0.22molCO���壬������ӦCH3OH��g��+CO��g��?CH3COOH��l������ü״���ת�������¶ȵı仯��ϵ��ͼ1��ʾ����������I��ʾ��5����ͬ�¶��£�������5minʱ��õļ״���ת���ʱ仯���ߣ����ߢ��ʾ��ͬ�¶��¼״���ƽ��ת���ʱ仯���ߣ���֪��T2�¶��£��ﵽƽ��ʱ����������պ�Ϊ2L��
��֪��2CO��g��+O2��g��=2CO2��g����H=-566kJ•mol-1
2CH3OH��g��+3O2��g��=2CO2��g��+4H2O��l����H=-1529kJ•mol-1
CH3COOHH��l��+2O2��g��=2CO2��g��+2H2O��l����H=-874kJ•mol-1
��Ҫ��ش��������⣺
��1����ҵ�����ᷴӦ��CH3OH��g��?CH3COOH��l����H-173.5kJ•mol-1
��2�����¶�ΪT3ʱ���ӷ�Ӧ��ʼ��5minʱ���õ�λʱ�������ʵ����仯��ʾ�������ƽ����Ӧ����Ϊ0.024mol•min-1��
��3�����¶�ΪT2ʱ���÷�Ӧ��ƽ�ⳣ��K=500����T3�¶��£�C��ʱ��v������=v���棩
��4������I��T1-T2�Σ��״�ת�������¶ȱ仯���ߵ�ԭ���Ƿ�Ӧδ��ƽ��״̬���������¶ȣ���ѧ��Ӧ���ʼӿ죬�ʼ״�ת�������¶ȵ����߶�����
��5�����¶�ΪT2ʱ���������ﵽƽ��ĺ�ѹ�����У�����˲��ͨ��0.12molCH3OH��0.06molCO������壬ƽ����ƶ�����Ϊ���ƶ�����������ҡ����ƶ������������Ǽ�������������ʵ�����ԭƽ������������ʵ�����ȣ������Ϊ4L��Qc=Qc=$\frac{1}{\frac{0.2}{4}��\frac{0.16}{4}}$=500=K��
��6�����¶�ΪT1ʱ����������ʵ�����ʱ��仯������������ͼ2��ʾ����ʱ�䵽��t1ʱ�����÷�Ӧ��ϵ�¶�Ѹ��������T3����ά�ָ��¶ȣ�����ͼ�л���t1ʱ�̺��������ʵ����ı仯���������ߣ�
���� ��1�����ݸ�˹���ɽ��м��㣬�ɣ���+�٣���2-�۵ó���ȷ���ۣ�
��2������v=$\frac{��c}{��t}$���м��㣻
��3�����ݼ״���ת���ʼ���ƽ��ʱ�����ʵ�Ũ�ȣ��ٸ���ƽ�ⳣ�������������Ũ����֮�����Է�Ӧ���Ũ����֮������ƽ�ⳣ����
ƽ��״̬ʱ�����淴Ӧ������ȣ�
��4�������ߢ��֪��T1-T2�Σ�5minʱ����Ӧδ��ƽ��״̬���������¶ȣ���ѧ��Ӧ���ʼӿ죬�״�ת�������¶ȵ����߶�����
��5������Ũ������ƽ�ⳣ���Ĵ�С��ϵ���жϷ�Ӧ���еķ���
��6����ʱ�䵽��t1ʱ�����÷�Ӧ��ϵ�¶�Ѹ��������T3����ά�ָ��¶ȣ��¶����ߣ�ƽ�������ƶ�����������ʵ�����С��һ��ʱ���ﵽƽ��״̬����������ʵ������ֲ��䣮
��� �⣺��1����2CO��g��+O2��g��=2CO2��g����H=-566kJ•mol-1
��2CH3OH��g��+3O2��g��=2CO2��g��+4H2O��l����H=-1529kJ•mol-1
��CH3COOH��l��+2O2��g��=2CO2��g��+2H2O��l����H=-874kJ•mol-1
�ɣ���+�٣���2-�۵ã�CH3OH��g��+CO��g��?CH3COOH��l����H=$\frac{��-566kJ•mo{l}^{-1}��+��-1529kJ•mo{l}^{-1}��}{2}$-��-874kJ•mol-1��=-173.5kJ•mol-1��
�ʴ�Ϊ��-173.5��
��2�������ߢ��֪��T2�¶��£�5minʱ��õļ״���ת����Ϊ60%����ת���ļ״������ʵ���Ϊ0.20mol��60%=0.12mol����������������ʵ���Ϊ0.12mol�������¶�ΪT3ʱ���ӷ�Ӧ��ʼ��5minʱ���õ�λʱ�������ʵ����仯��ʾ�������ƽ����Ӧ����Ϊ$\frac{0.12mol}{5min}$=0.024mol•min-1��
�ʴ�Ϊ��0.024��
��3���ɽ��2����֪�����¶�ΪT2ʱ��ת���ļ״������ʵ���Ϊ0.12mol����ת����CO�����ʵ���Ϊ0.12mol����ƽ��ʱ�״������ʵ���Ϊ0.20mol-0.12mol=0.08mol��CO�����ʵ���Ϊ0.22mol-0.12mol=0.1mol����ƽ�ⳣ��K=$\frac{1}{c��C{H}_{3}OH��•c��CO��}$=$\frac{1}{\frac{0.08}{2}��\frac{0.1}{2}}$=500��
��T3�¶��£�C��ʱ��Ӧ�Ѵ�ƽ��״̬�������淴Ӧ������ȣ���v������=v���棩��
�ʴ�Ϊ��500��=��
��4�������ߢ��֪��T1�¶��£�5minʱ����Ӧδ��ƽ��״̬���������¶ȣ���ѧ��Ӧ���ʼӿ죬�ʼ״�ת�������¶ȵ����߶�����
�ʴ�Ϊ����Ӧδ��ƽ��״̬���������¶ȣ���ѧ��Ӧ���ʼӿ죬�ʼ״�ת�������¶ȵ����߶�����
��5��ԭƽ����ϵ�������ܵ����ʵ���Ϊ0.08mol+0.1mol=0.18mol�����Ϊ2L��
���¶�ΪT2ʱ���������ﵽƽ��ĺ�ѹ�����У�����˲��ͨ��0.12molCH3OH��0.06molCO������壬���������ܵ����ʵ���Ϊ0.12mol+0.06mol=0.18mol��ԭƽ����ȣ��������Ϊԭ����2������ʱ���״������ʵ���Ϊ0.08mol+0.12mol=0.2mol��CO�����ʵ���Ϊ0.1mol+0.06mol=0.16mol����Qc=$\frac{1}{\frac{0.2}{4}��\frac{0.16}{4}}$=500=K����ƽ�ⲻ�ƶ���
�ʴ�Ϊ�����ƶ�����������������ʵ�����ԭƽ������������ʵ�����ȣ������Ϊ4L��Qc=Qc=$\frac{1}{\frac{0.2}{4}��\frac{0.16}{4}}$=500=K��
��6����ʱ�䵽��t1ʱ�����÷�Ӧ��ϵ�¶�Ѹ��������T3����ά�ָ��¶ȣ��¶����ߣ�ƽ�������ƶ�����������ʵ�����С��һ��ʱ���ﵽƽ��״̬����������ʵ������ֲ��䣬��t1ʱ�̺�ı仯����������Ϊ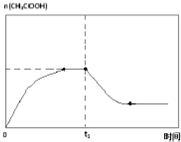 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
���� ���⿼���˹���ɵ�Ӧ�á�ƽ��ͼ�������ƽ�ⳣ���ļ������ѧƽ���ƶ�ԭ�����ѶȽϴ�Ҫע�����Ũ������ƽ�ⳣ�����жϷ�Ӧ���еķ���

| A�� | �ڱ���Һ��Ļ�����У�����������м�����Ͼ��ҷ�Ӧ | |
| B�� | �����ƿ�ĵ���Ҫ���㹻���ȣ��������ǵ�������ͳ�����������ݳ��ı��������� | |
| C�� | ����ĩ��Ӧ������ƿ��ˮ�����£�������HBr���屻���� | |
| D�� | ��Ӧ����ƿ���Ǻ�ɫ����״Һ�壬����ʢ������Ũ�ռ���Һ�ķ�Һ©���У�������ã��ϲ�Һ������ɫ���屽 |
��
 ��
�� ��
��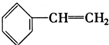 ��C2H4��CH2�TCH-CH�TCH2��C3H6
��C2H4��CH2�TCH-CH�TCH2��C3H6��
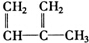 ��
��
| A�� | �ٺ� �� | B�� | �ܺ͢� | C�� | �ݺ͢� | D�� | �ߺ͢� |
| A�� | ���ᱡ�ɴ�����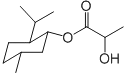 �����ܷ���ˮ�⡢��������ȥ��Ӧ �����ܷ���ˮ�⡢��������ȥ��Ӧ | |
| B�� | ��ȩ�ͱ�ϩȩ��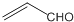 ������ͬϵ�������������ַ�Ӧ��IJ�����ͬϵ�� ������ͬϵ�������������ַ�Ӧ��IJ�����ͬϵ�� | |
| C�� | ��ϩ��������ϩ�ͱ������о�����̼̼˫�� | |
| D�� | CH3COOCH2CH3��CH3CH2COOCH3��Ϊͬ���칹�壬�˴Ź���������ʾ���߾������ֲ�ͬ����ԭ����������ԭ�ӵı�����ͬ���ʲ����ú˴Ź��������� |
| A�� | ͭ��Ũ���ᷴӦ���ð�ɫ�������CuSO4 | |
| B�� | ��BaCl2��Һ�����ð�ɫ������BaSO3 | |
| C�� | ��ɫ������м��ӵ�������ɫ�������в����ܺ���CuO | |
| D�� | ��ɫ������м��ӵ�������ɫ�������к�Ԫ��Cu��S |

| A�� | ͼ1��ʾ0.10mol•L-1NaOH��Һ�ζ�20.00mL0.10mol•L-1������Һ�ĵζ����� | |
| B�� | ͼ2��ʾ������Һ��ͨ�백����������������Һ������I�ı仯 | |
| C�� | ����ͼ3��ʾ��֪��ʯī�Ƚ��ʯ�ȶ� | |
| D�� | ͼ4��ʾ��Ӧ��2SO2+O2?2SO3��t1ʱ��ֻ��С��SO3��Ũ�� |
| A�� | ͬһ�����еĵڢ�A��͵ڢ�A��Ԫ�ص�ԭ��������һ��Ϊ1 | |
| B�� | L���ϵĵ�����Ϊ������Ԫ��һ��������Ԫ�� | |
| C�� | ͬһ���������������ڵ�Ԫ�ص�ԭ��������Ϊ��һ��������Ԫ������ | |
| D�� | ��������������������Ԫ��һ���ǽ���Ԫ�� |
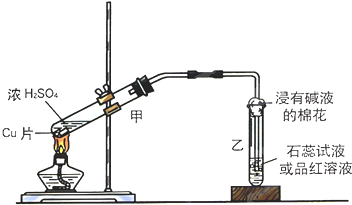 ʵ���ҳ�������װ��������ͭ��Ũ���ᷴӦ��һϵ��ʵ�飮
ʵ���ҳ�������װ��������ͭ��Ũ���ᷴӦ��һϵ��ʵ�飮 X��Y��Ԫ�����ڱ�ǰ20��Ԫ�أ���X��ԭ��������Y��4������գ�X��YҪ�þ����Ԫ�ط��ű�ʾ����
X��Y��Ԫ�����ڱ�ǰ20��Ԫ�أ���X��ԭ��������Y��4������գ�X��YҪ�þ����Ԫ�ط��ű�ʾ����