题目内容
16.某混合气体由两种烃等体积分数组成,标准状况下1.12L该混合气体在足量氧气中完全燃烧.若将产物通入足量澄清石灰水,得到的白色沉淀质量为7.5g;若用足量碱石灰吸收燃烧产物,增重5.1g.通过计算推断混合气体由哪两种烃组成.分析 白色沉淀7.5g为碳酸钙的质量,根据n=$\frac{m}{M}$计算碳酸钙的物质的量,根据碳原子守恒计算n(CO2),根据m=nM计算二氧化碳的质量,碱石灰增重9.3g为燃烧生成的二氧化碳与水,据此计算生成水的质量,利用原子守恒计算该气态烃的分子式,注意混合气体中两种烃体积分数相等这一条件,据此确定组成.
解答 解:(1)白色沉淀7.5g为碳酸钙的质量,故碳酸钙的物质的量=$\frac{7.5g}{100g/mol}$=0.075mol,n(CO2)=n(CaCO3)=0.075mol,m(CO2)=0.075mol×44g/mol=3.3g,碱石灰增重5.1g为燃烧生成的二氧化碳与水,故m(H2O)=5.1g-3.3g=1.8g,n(H2O)=0.1mol,则n(H)=n(H2O)×2=0.2mol,
n(C)=0.075mol,1.12L该气态烃的物质的量=$\frac{1.12L}{22.4L/mol}$=0.05mol,
故该烃中平均原子个数:N(C)=1.5、N(H)=4,所以一定含有甲烷,混合气体由两种烃等体积分数组成,所以另一种烃中氢个数也是4,碳个数只能是2,为乙烯,即混合气体由甲烷和乙烯组成.
答:混合气体由甲烷和乙烯组成.
点评 本题考查有机物分子式的确定,难度不大,注意掌握燃烧法利用守恒思想确定有机物分子组成方法,侧重对学生思维能力的考查.

练习册系列答案
相关题目
5.分子式为C4H8O3的有机物,在一定条件下具有下列性质:①在浓硫酸存在下,能分别与CH3CH2OH或CH3COOH反应;②在浓硫酸存在下,亦能脱水生成一种只存在一种结构形式,且能使溴水褪色的物质;③在浓硫酸存在下,还能生成一种分子式为C4H6O2的五元环状化合物.根据上述性质,确定C4H8O3的结构简式为( )
| A. | HOCH2COOCH2CH3 | B. | CH3CH(OH)CH2COOH | C. | HOCH2CH2CH2COOH | D. | CH3CH2CH(OH)COOH |
4.实验室利用电石渣(主要含CaO、CaC2及少量C、SiO2)为原料制备氯酸钾的实验流程及相关物质的溶解度如图:
(1)化灰池中CaC2与水反应的化学方程式为CaC2+2H2O→Ca(OH)2+HC≡CH↑.
(2)在80℃氯化时产生氯酸钙及氯化钙的化学方程式为6Cl2+6Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ 5CaCl2+Ca(ClO3)2+6H2O;除去溶液中多余的氯气的简单方法是将溶液加热.
(3)饱和KCl溶液能与氯酸钙反应的原因是KClO3的溶解度比Ca(ClO3)2小.
(4)滤渣中的成分主要是C、SiO2(写化学式);从过滤后的溶液中获得KClO3晶体的方法是蒸发结晶、趁热过滤、洗涤、烘干.

| 几种物质溶解度与温度的关系 | |||||
| 温度 | 0 | 10 | 20 | 30 | 40 |
| S(CaCl2)/g | 59.5 | 64.7 | 74.5 | 100 | 128 |
| S[Ca(ClO3)2]/g | 209 | ||||
| S(KClO3)/g | 3.3 | 5.2 | 7.3 | 10.2 | 13.9 |
(2)在80℃氯化时产生氯酸钙及氯化钙的化学方程式为6Cl2+6Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ 5CaCl2+Ca(ClO3)2+6H2O;除去溶液中多余的氯气的简单方法是将溶液加热.
(3)饱和KCl溶液能与氯酸钙反应的原因是KClO3的溶解度比Ca(ClO3)2小.
(4)滤渣中的成分主要是C、SiO2(写化学式);从过滤后的溶液中获得KClO3晶体的方法是蒸发结晶、趁热过滤、洗涤、烘干.

11.一定温度下,在三个体积约为2.0L的恒容密闭容器中发生反应:2CH3OH(g)=CH3OCH3(g)+H2O(g)
回答下列问题:
(1)反应的△H小于0(填“大于”或“小于”)判断的理由是反应Ⅰ、Ⅲ起始量相同,Ⅰ的CH3OCH3(g)含量低,说明降温正向移动,正反应为放热过程△H<0,容器Ⅰ到达平衡所需的时间为20min反应速率v(CH2OH)为0.004mol•L-1•min-1,列式求算387℃时该反应的平衡常数K1=4
(2)容器Ⅱ达平衡时,压强是容器Ⅰ的两倍,CH3OH的体积分数和容器Ⅰ中的相同,CH3OH起始的物质的量为0.40mol;平衡时CH3OCH3(g)的体积分数为0.4
(3)t分钟后容器Ⅲ达到平衡,t大于20min(填“大于”、“等于”或“小于”)判断的理由是温度越低,反应速率越小,达到平衡时所需的时间越长请在图中分别画出容器Ⅰ和容器Ⅱ中CH3OH(g)浓度变化的曲线示意图

(4)208℃,若向3L容器中充入0.9molCH3OH(g),0.6molCH3OCH3(g)和0.3molH2O(g),则起始时该反应的v正>v逆(填“>”“<”或“=”)
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | |||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
(1)反应的△H小于0(填“大于”或“小于”)判断的理由是反应Ⅰ、Ⅲ起始量相同,Ⅰ的CH3OCH3(g)含量低,说明降温正向移动,正反应为放热过程△H<0,容器Ⅰ到达平衡所需的时间为20min反应速率v(CH2OH)为0.004mol•L-1•min-1,列式求算387℃时该反应的平衡常数K1=4
(2)容器Ⅱ达平衡时,压强是容器Ⅰ的两倍,CH3OH的体积分数和容器Ⅰ中的相同,CH3OH起始的物质的量为0.40mol;平衡时CH3OCH3(g)的体积分数为0.4
(3)t分钟后容器Ⅲ达到平衡,t大于20min(填“大于”、“等于”或“小于”)判断的理由是温度越低,反应速率越小,达到平衡时所需的时间越长请在图中分别画出容器Ⅰ和容器Ⅱ中CH3OH(g)浓度变化的曲线示意图

(4)208℃,若向3L容器中充入0.9molCH3OH(g),0.6molCH3OCH3(g)和0.3molH2O(g),则起始时该反应的v正>v逆(填“>”“<”或“=”)
1.丙烯酸的结构简式为CH2=CH-COOH,其对应的性质中不正确的是( )
| A. | 与钠反应放出氢气 | B. | 能与溴水发生加成反应 | ||
| C. | 能与溴水发生取代反应 | D. | 能发生加聚反应生成高分子化合物 |
8.设C(S)+CO2(g)?2CO (g)△H>0,反应速度为V1;
N2(g)+3H2(g)?2NH3 (g)△H<0,反应速度为V2,
对于上述反应,当温度升高时,V1和V2的变化情况正确的是( )
N2(g)+3H2(g)?2NH3 (g)△H<0,反应速度为V2,
对于上述反应,当温度升高时,V1和V2的变化情况正确的是( )
| A. | 同时增大 | B. | 同时减小 | C. | 增大,减小 | D. | 减小,增大 |
6.我国于2009年12月1日起实施新的国家强制标准《塑料一次性餐饮具通用技术要求》,其中规定只有完全降解变成CO2或CH4、H2O等物质的一次性餐饮具才能标注为“可降解餐饮具”,这将有利于减少“白色污染”.新型材料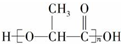 可在乳酸菌作用下完全降解,可代替聚苯乙烯制作一次性餐饮具,下列有关该材料的说法错误的是( )
可在乳酸菌作用下完全降解,可代替聚苯乙烯制作一次性餐饮具,下列有关该材料的说法错误的是( )
 可在乳酸菌作用下完全降解,可代替聚苯乙烯制作一次性餐饮具,下列有关该材料的说法错误的是( )
可在乳酸菌作用下完全降解,可代替聚苯乙烯制作一次性餐饮具,下列有关该材料的说法错误的是( )| A. | 合成该材料的单体为 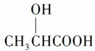 | |
| B. | 该合成材料的单体在氢氧化钠溶液作用下可形成环酯 | |
| C. | 合成该材料的方式与聚苯乙烯不同 | |
| D. | 该材料在一定条件下可发生水解 |
