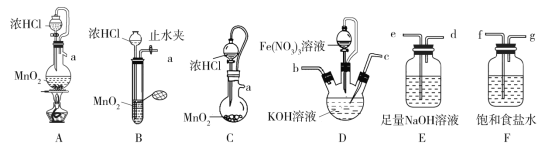
题目内容
【题目】短周期主族元素A、B、C、D、E的原子序数依次增大,其单质常温下有三种气态两种固态,A和B形成的气态化合物的水溶液可使红色石蕊试纸变蓝,A和C同主族,D原子最外层电子数与电子层数相等,E的原子半径在同周期最小,下列说法不正确的是:
A. 原子半径大小:r(D) > r(E)
B. C和氧元素形成的化合物可能含有非极性键
C. E形成的单质具有漂白性
D. C、D的最高价氧化物对应的水化物之间能发生反应
【答案】C
【解析】
短周期主族元素A、B、C、D的原子序数依次增大,A和B形成的气态化合物的水溶液呈碱性,该气体为![]() ,结合原子序数大小,可推知A为氢元素、B为N元素;A和C同主族,C的原子序数大于N,则C为Na;D原子序数大于Na,处于第三周期,D原子最外层电子数与电子层数相等,则D为Al,E的原子半径在同周期最小,则E为Cl。综上所述A为H,B为N,C为Na,D为Al,E为Cl。
,结合原子序数大小,可推知A为氢元素、B为N元素;A和C同主族,C的原子序数大于N,则C为Na;D原子序数大于Na,处于第三周期,D原子最外层电子数与电子层数相等,则D为Al,E的原子半径在同周期最小,则E为Cl。综上所述A为H,B为N,C为Na,D为Al,E为Cl。
A. 同周期元素,从左到右原子半径依次减小,故A正确;
B. C和氧形成的化合物有![]() 和
和![]() ,
,![]() 中含有非极性键,故B正确;
中含有非极性键,故B正确;
C. 干燥的氯气不具有漂白性,氯水具有漂白性,故C错误;
D. C、D的最高价氧化物对应水化物分别为NaOH和![]() ,
,![]() 可以跟NaOH溶液反应,故D正确;
可以跟NaOH溶液反应,故D正确;
故答案选C。

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案【题目】请按要求填写下列空白:
主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在元素①②⑤⑥⑦⑧对应的最高价氧化物的水化物中,碱性最强的化合物的电子式是:_________________________________________;
(2)写出元素②的最简单氢化物的结构式_________________________;
(3)④⑤⑥⑦四种元素的简单离子半径从大到小排序____________(用离子符号表示);
(4)写出元素⑥的最高价氧化物与元素⑤的最高价氧化物的水化物反应的离子方程式______;
(5)写出元素③的常见氢化物和它的最高价氧化物的水化物反应的化学方程式____________。