题目内容
【题目】常温下,向100mL0.lmol/LNH4Cl溶液中,逐滴滴加0.1mol/LNaOH溶液。NH4+和NH3H2O的变化趋势如图所示(不考虑生成NH3,已知NH3H2O的kb=1.8![]() 10-5),下列说法正确的是( )
10-5),下列说法正确的是( )

A.a=0.005
B.在M点时,n(H+)—n(OH—)=(0.005—a)mol
C.随着NaOH溶液的滴加, 不断增大
不断增大
D.当n((NaOH)) =0.01 mol 时,c ((NH3H2O)![]() c (Na+)
c (Na+)![]() c (OH-)
c (OH-)
【答案】B
【解析】
A.由图可知,M点含等量的氯化铵和NH3H2O,由NH3H2O![]() NH4++ OH-,可知此时溶液中kb=1.8
NH4++ OH-,可知此时溶液中kb=1.8![]() 10-5=
10-5=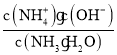 ,则c(OH-)= 1.8
,则c(OH-)= 1.8![]() 10-5mol/L,溶液显碱性,即n(OH-)- n(H+)>0,由溶液中存在的电荷守恒式为n(OH-)+n(Cl-)=n(H+)+n(Na+)+n(NH4+),n(Na+)= n(OH-)+n(Cl-)- n(NH4+)- n(H+)=0.005+ n(OH-)- n(H+)>0.005,即a>0.005,故A错误;
10-5mol/L,溶液显碱性,即n(OH-)- n(H+)>0,由溶液中存在的电荷守恒式为n(OH-)+n(Cl-)=n(H+)+n(Na+)+n(NH4+),n(Na+)= n(OH-)+n(Cl-)- n(NH4+)- n(H+)=0.005+ n(OH-)- n(H+)>0.005,即a>0.005,故A错误;
B.M点n(OH-)+n(Cl-)=n(H+)+n(Na+)+n(NH4+),n(H+)-n(OH-)=n(Cl-)-0.005-n(Na+)=(0.005-a)mol,故B正确;
C.随着NaOH溶液的滴加,c(NH3H2O)减小,且 =
=![]() ,可知比值不断减小,故C错误;
,可知比值不断减小,故C错误;
D.当n(NaOH)=0.01mol时,恰好反应生成等量的氯化钠和一水合氨,一水合氨电离,则c( Na+)>c(NH3H2O)>c(OH-),故D错误;
故答案为B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目