题目内容
【题目】高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂。已知:K2FeO4易溶于水、微溶于浓碱溶液,不溶于乙醇,在0~5 ℃的强碱性溶液中较稳定。实验室中常用KClO在强碱性介质中与Fe(NO3)3反应制备K2FeO4(夹持装置略去)。回答下列问题:
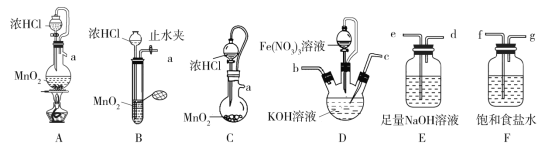
(1)盛放Fe(NO3)3溶液的仪器名称为______________________。
(2)氯气的发生装置可以选择图中的________(用图中大写字母表示);检查装置B气密性的操作为___________。
(3)选择上述装置,制备K2FeO4,按气流从左到右的方向,合理的连接顺序a→______(填仪器接口字母,仪器不可重复使用)。
(4)装置D中生成K2FeO4的离子方程式为__________;实验过程中若装置D的液面上方出现黄绿色气体后,再滴加Fe(NO3)3溶液会产生大量红褐色沉淀,用必要的文字和离子方程式分析原因:_______________
(5)制备的高铁酸钾粗产品中含有KNO3、KCl、Fe(OH)3等杂质,请将以下提纯步骤补充完整,(实验药品:高铁酸钾粗产品、蒸馏水、乙醇、饱和NaOH溶液、饱和KOH溶液、冷的稀KOH溶液、冰水)。
①取一定量的高铁酸钾粗产品,溶于_____________;
②过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液;
③搅拌、静置、过滤,用____________洗涤2~3次,在真空干燥箱中干燥。
【答案】恒压分液漏斗 A 关闭止水夹,向长颈漏斗中注水至漏斗中的液面高于试管中的液面,且一段时间内液面差不变,即可证明气密性良好 f→g→c→b→e 2Fe3++3ClO+10OH=2FeO42-+3Cl+5H2O ClO、Fe3+能发生双水解反应生成红褐色的Fe(OH)3:3ClO+Fe3++3H2O=Fe(OH)3↓+3HClO 冷的稀KOH溶液 乙醇
【解析】
(1)根据图示及仪器构造判断;
(2)氯气制备采用固体和液体加热制气体装置,有长颈漏斗的装置气密性的检查是加水封闭一段气体观察液面差的变化;
(3)有气体参加的反应仪器连接顺序:制备气体、净化、反应、尾气吸收;
(4)反应中Fe3+被氧化为FeO42-,ClO-被还原为Cl可写出方程式,ClO、Fe3+双水解;
(5)根据题中K2FeO4易溶于水、微溶于浓碱溶液,不溶于乙醇,KNO3、KCl溶于水,Fe(OH)3不溶于水进行提纯。
(1)根据仪器构造,玻璃管可以平衡压强,仪器为恒压分液漏斗,
故答案为:恒压分液漏斗;
(2)用MnO2和浓HCl加热反应制备氯气,应选用固体和液体加热制气体装置,所以选A;B装置中有长颈漏斗,气密性的检查应封闭体系,向长颈漏斗内加水使长颈漏斗和试管内产生液面差,一段时间后观察液面差有无变化,检查装置的气密性,
故答案为:A;关闭止水夹,向长颈漏斗中注水至漏斗中的液面高于试管中的液面,且一段时间内液面差不变,即可证明气密性良好;
(3)用KClO在强碱性介质中与Fe(NO3)3反应制备K2FeO4,应先制备氯气,制得氯气中含氯化氢杂质,用饱和食盐水除去氯化氢,然后氯气和KOH反应生成KClO,KClO再和Fe(NO3)3反应生成K2FeO4,氯气是有毒气体,装置最后用氢氧化钠吸收,减免空气污染, 气体与溶液反应或洗气都应是长导管进气体,气体从短导管出,所以选A、F、D、E,导管长进短出,
故答案为:f→g→c→b→e
(4)反应中Fe3+被氧化为FeO42-,ClO-被还原为Cl,反应在碱性条件进行,据电子守恒、原子守恒、电荷守恒写出方程式为:2Fe3++3ClO+10OH=2FeO42-+3Cl+5H2O,若装置D的液面上方出现黄绿色气体后,氯气已过量,溶液中含KCl和KClO,加入硝酸铁溶液,ClO、Fe3+发生双水解反应,反应的离子方程式为3ClO+Fe3++3H2O=Fe(OH)3↓+3HClO。
故答案为:2Fe3++3ClO+10OH=2FeO42-+3Cl+5H2O;ClO、Fe3+能发生双水解反应生成红褐色的Fe(OH)3:3ClO+Fe3++3H2O=Fe(OH)3↓+3HClO
(5)根据题中K2FeO4易溶于水、微溶于浓碱溶液,不溶于乙醇,KNO3、KCl溶于水,Fe(OH)3不溶于水进行提纯。
①由题中文字叙述知第一步操作后,产品在滤液中,除去的是Fe(OH)3,所以用冷的稀KOH溶液,故答案为:冷的稀KOH溶液;
③第二步操作中用饱和氢氧化钾溶液,产品难溶,除去易溶于水的KNO3、KCl,产品在滤渣中,第三步应减少产品损失用乙醇洗涤,故答案为:乙醇。

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案