题目内容
18.向一定量的Fe、FeO、Fe2O3的混合物中加入100mL浓度为1.0mol•L-1的盐酸,恰好使混合物完全溶解,放出224mL的气体(标准状况),所得溶液中加入KSCN溶液后无血红色出现.若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是( )| A. | 11.2 g | B. | 5.6 g | C. | 2.8 g | D. | 1.4 g |
分析 盐酸恰好使混合物完全溶解,盐酸没有剩余,向反应所得溶液加KSCN溶液无血红色出现,说明溶液为氯化亚铁溶液,根据氯离子守恒可知n(FeCl2),用足量的H2在高温下还原相同质量的混合物得到铁,根据铁元素守恒可知n(Fe)=n(FeCl2),据此结合m=nM计算得到的铁的质量.
解答 解:盐酸恰好使混合物完全溶解,盐酸没有剩余,向反应所得溶液加KSCN溶液无血红色出现,说明溶液为FeCl2溶液,n(HCl)=0.1L×1mol/L=0.1mol,根据氯离子守恒可知n(FeCl2)=0.05mol,用足量的H2在高温下还原相同质量的混合物得到铁,根据铁元素守恒可知n(Fe)=n(FeSO4)=0.05mol,故得到Fe的质量为0.05mol×56g/mol=2.8g,
故选C.
点评 本题考查混合物的计算,难度中等,利用元素守恒判断铁的物质的量是解题关键,注意守恒思想的运用.

练习册系列答案
相关题目
6.下列热化学方程式中,能够表示物质燃烧热的是( )
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5 kJ/mol | |
| B. | H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ/mol | |
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8 kJ/mol | |
| D. | C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l)△H=-5518 kJ/mol |
13.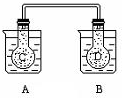 如图所示,在常况下容器A中盛有500mL蒸馏水,在容器B中盛有 500ml 1mol/L的盐酸,在烧瓶C和D中充满二氧化氮气体,并用导管将它们连通.向A容器中加入50g硝酸铵晶体,小心搅拌,使其迅速溶解;向B中加入10g苛性钠固体,小心搅拌也使其迅速溶解,随着A、B中固体物质的溶解,烧瓶C和D中气体的颜色变化是( )
如图所示,在常况下容器A中盛有500mL蒸馏水,在容器B中盛有 500ml 1mol/L的盐酸,在烧瓶C和D中充满二氧化氮气体,并用导管将它们连通.向A容器中加入50g硝酸铵晶体,小心搅拌,使其迅速溶解;向B中加入10g苛性钠固体,小心搅拌也使其迅速溶解,随着A、B中固体物质的溶解,烧瓶C和D中气体的颜色变化是( )
 如图所示,在常况下容器A中盛有500mL蒸馏水,在容器B中盛有 500ml 1mol/L的盐酸,在烧瓶C和D中充满二氧化氮气体,并用导管将它们连通.向A容器中加入50g硝酸铵晶体,小心搅拌,使其迅速溶解;向B中加入10g苛性钠固体,小心搅拌也使其迅速溶解,随着A、B中固体物质的溶解,烧瓶C和D中气体的颜色变化是( )
如图所示,在常况下容器A中盛有500mL蒸馏水,在容器B中盛有 500ml 1mol/L的盐酸,在烧瓶C和D中充满二氧化氮气体,并用导管将它们连通.向A容器中加入50g硝酸铵晶体,小心搅拌,使其迅速溶解;向B中加入10g苛性钠固体,小心搅拌也使其迅速溶解,随着A、B中固体物质的溶解,烧瓶C和D中气体的颜色变化是( )| A. | 不变 | B. | 烧瓶C中颜色变深,D中变浅 | ||
| C. | 烧瓶D中变深,C中变浅 | D. | 两个烧瓶中的颜色都变深 |
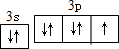
7.某元素的离子带2个单位正电荷,它的核外电子排布为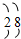 ,此元素在周期表中的位置是( )
,此元素在周期表中的位置是( )
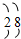 ,此元素在周期表中的位置是( )
,此元素在周期表中的位置是( )| A. | 第二周期零族 | B. | 第三周期ⅡA族 | C. | 第二周期ⅥA族 | D. | 第三周期IIIA |

 .
. ,其单质在常温下为黄绿色的气体,实验中可以用NaOH溶液吸收,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
,其单质在常温下为黄绿色的气体,实验中可以用NaOH溶液吸收,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.