题目内容
17.有关晶体结构的叙述中,错误的是( )| A. | 分子晶体中相对分子质量大的熔、沸点一定比相对分子质量小的高 | |
| B. | 在氯化钠晶体中,每个氯离子周围都紧邻12个氯离子 | |
| C. | 在金属铜的晶体中,由于存在自由电子,因此铜能导电 | |
| D. | 金刚石的网状结构中,最小的环上有6个碳原子 |
分析 A、影响分子晶体熔、沸点的因素为氢键和相对分子质量;
B、在氯化钠晶体中,如图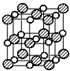 假设体心上的是氯离子,则每个氯离子周围都紧邻氯离子位于12个棱的中心上,有12个,据此判断;
假设体心上的是氯离子,则每个氯离子周围都紧邻氯离子位于12个棱的中心上,有12个,据此判断;
C、金属导电是原因金属晶体中存在自由移动的电子;
D、根据金刚石的晶胞结构图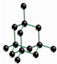 ,可以看出最小的环上有6个碳原子,据此判断;
,可以看出最小的环上有6个碳原子,据此判断;
解答 解:A、影响分子晶体熔、沸点的因素为氢键和相对分子质量,所以相对分子质量大的熔、沸点不一定比相对分子质量小的高,例如水大于硫化氢,故A错误;
B、在氯化钠晶体中,如图 假设体心上的是氯离子,则每个氯离子周围都紧邻氯离子位于12个棱的中心上,有12个,故B正确;
假设体心上的是氯离子,则每个氯离子周围都紧邻氯离子位于12个棱的中心上,有12个,故B正确;
C、金属导电是原因金属晶体中存在自由移动的电子,故C正确;
D、根据金刚石的晶胞结构图 ,可以看出最小的环上有6个碳原子,故D正确;
,可以看出最小的环上有6个碳原子,故D正确;
故选A.
点评 本题考查了晶体的有关知识,题目比较简单,注意对常见晶体晶胞的分析.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
7.下列说法错误的是( )
| A. | 摘下几根火柴头,浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸,若出现白色沉淀,说明含氯元素 | |
| B. | 纸层析法分离叶绿素a和叶绿素b时,若点样的斑点太大,则会导致色谱分离不清 | |
| C. | 在抽滤装置中洗涤沉淀时,应关小水龙头,使洗涤剂缓慢通过沉淀物 | |
| D. | 在Zn-Cu原电池中加入高锰酸钾、双氧水等强氧化剂,灯泡亮度增加且持续时间较长 |
8.下列叙述正确的是( )
| A. | Fe与S混合加热生成FeS2 | |
| B. | NaHCO3的热稳定性大于Na2CO3 | |
| C. | 白磷在空气中加热到一定温度能转化为红磷 | |
| D. | 过量的铜与稀硝酸反应有一氧化氮生成 |
12.下列物质的主要成分不是甲烷的是( )
| A. | 沼气 | B. | 天然气 | C. | 裂解气 | D. | 可燃冰 |
6.2008年北京奥运会“祥云”火炬用的是环保型燃料--丙烷(C3H8),悉尼奥运会火炬所用燃料为65%丁烷(C4H10)和35%丙烷,下列有关说法正确的是( )
| A. | 丙烷分子中三个碳原子在一条直线上 | |
| B. | 符合通式CnH2n+2的均属于烷烃 | |
| C. | 丙烷的二氯代物有5种 | |
| D. | 丁烷能与氯气在光照时发生加成反应 |