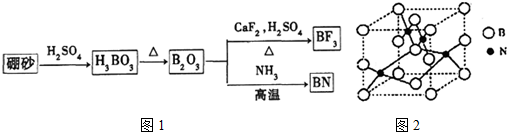
题目内容
9.T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增.已知:①W的原子序数为29,其余的均为短周期主族元素;
②T原子所处的周期数、族序数分别与其原子序数相等;
③X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同;
④Z的基态原子价电子排布为ns2npn+2;
⑤在该元素所在周期中,Q的基态原子的第一电离能最小;
⑥R的单质常温常压下是气体,其基态原子的M层上有1个未成对的p电子;
(1)Y的氢化物分子间能形成氢键,R的氢化物分子间不易形成氢键,原因是Cl的原子半径比N大.
(2)W的基态原子的核外电子排布式为1s22s22p63s23p63d104s1,该元素与元素X、Y能形成的[W(XY)4]2-离子中,含有的化学键是bd.
a.离子键 b.极性键 c.非极性键 d.配位键
(3)T、X、Z三种元素组成的一种化合物M是新装修居室中常见的有害气体,它的分子式为XT2Z,分子空间构型为平面三角形,则该分子中中心原子采取sp2杂化,1molM分子中σ键和π键的个数比为3:1.
(4)X与Y原子结合形成的X3Y4晶体,其晶体结构与金刚石类似,但硬度比金刚石大,请解释原因是C3N4与金刚石均原子晶体,由于N原子半径小于碳原子半径,故C-N键长比C-C键长短,C-N键能更大,更稳定,所以C3N4晶体硬度大.
分析 T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增.已知:
①W的原子序数为29,其余的均为短周期主族元素,则W是Cu元素;
②T原子所处的周期数、族序数分别与其原子序数相等,则T是H元素;
③X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同,原子核外电子排布为1s22s22p2,故X为C元素;
⑤在该元素所在周期中,Q的基态原子的第一电离能最小,则Q为Na;
④Z的基态原子价电子排布为ns2npn+2,且Z原子序数小于Q,Z属于第二周期元素,所以n=2,则Z是O元素,Y原子序数介于碳、氧之间,故Y是N元素;
⑥R的单质常温常压下是气体,其基态原子的M层上有1个未成对的p电子,且原子序数大于Q,则R是Cl元素.
解答 解:T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增.已知:
①W的原子序数为29,其余的均为短周期主族元素,则W是Cu元素;
②T原子所处的周期数、族序数分别与其原子序数相等,则T是H元素;
③X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同,原子核外电子排布为1s22s22p2,故X为C元素;
⑤在该元素所在周期中,Q的基态原子的第一电离能最小,则Q为Na;
④Z的基态原子价电子排布为ns2npn+2,且Z原子序数小于Q,Z属于第二周期元素,所以n=2,则Z是O元素,Y原子序数介于碳、氧之间,故Y是N元素;
⑥R的单质常温常压下是气体,其基态原子的M层上有1个未成对的p电子,且原子序数大于Q,则R是Cl元素.
(1)Y的氢化物为氨气,R的氢化物为HCl,氨气分子间易形成氢键,而Cl的原子半径比N大,HCl分子之间不易形成氢键
故答案为:Cl的原子半径比N大;
(2)W为Cu,其基态原子电子排布式为:1s22s22p63s23p63d104s1,该元素与元素X、Y能形成的[Cu(CN)4]2-离子,Cu2+离子与CN-离子之间形成配位键,CN-离子中碳原子与氮原子之间形成极性键,
故答案为:1s22s22p63s23p63d104s1;bd;
(3)XT2Z的分子式为CH2O,结构式为 ,碳原子形成3个σ键,没有孤电子对,则C原子采取sp2杂化,1mol该分子中σ键和π键的个数比为3:1,
,碳原子形成3个σ键,没有孤电子对,则C原子采取sp2杂化,1mol该分子中σ键和π键的个数比为3:1,
故答案为:sp2;3:1;
(4)C与N原子结合形成的C3N4晶体,其晶体结构与金刚石类似,都属于原子晶体,由于N原子半径小于碳原子半径,故C-N键长比C-C键长短,C-N键能更大,更稳定,所以C3N4晶体硬度大,
故答案为:C3N4与金刚石均原子晶体,由于N原子半径小于碳原子半径,故C-N键长比C-C键长短,C-N键能更大,更稳定,所以C3N4晶体硬度大.
点评 本题考查是对物质结构和性质的考查,涉及氢键、核外电子排布、化学键、配合物、杂化轨道、晶体类型与性质,正确推断元素是解本题关键,难度中等.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案(1)常温下,浓度均为 0.l mol•L-1的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
②浓度均为0.0l mol•L-1的下列五种物质的溶液中,酸性最强的是D(填编号);将各溶液分别稀释100倍,pH变化最小的是C(填编号)
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③据上表数据,请你判断下列反应不能成立的是D(填编号)
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+NaClO═NaHCO3+HClO
D.CO2+H2O+2C6H5ONa═Na2CO3+2C6H5OH
④要增大氯水中HC1O的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为Cl2+HCO3-+H2O=CO2↑+Cl-+HClO.
(2)已知常温下Cu(OH)2的Ksp=2×10-20.又知常温下某CuSO4溶液里 c(Cu2+)=0.02mol•L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于5.
| A. | 分子晶体中相对分子质量大的熔、沸点一定比相对分子质量小的高 | |
| B. | 在氯化钠晶体中,每个氯离子周围都紧邻12个氯离子 | |
| C. | 在金属铜的晶体中,由于存在自由电子,因此铜能导电 | |
| D. | 金刚石的网状结构中,最小的环上有6个碳原子 |
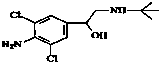 今年央视“315特别行动”又曝光了河南一些地方“瘦肉精”事件.“瘦肉精”对人体健康会产生危害.已知某“瘦肉精”中含有克伦特罗(Clenbuterol),其结构如图.下列有关克伦特罗的叙述,不正确的是( )
今年央视“315特别行动”又曝光了河南一些地方“瘦肉精”事件.“瘦肉精”对人体健康会产生危害.已知某“瘦肉精”中含有克伦特罗(Clenbuterol),其结构如图.下列有关克伦特罗的叙述,不正确的是( )| A. | 该物质的分子式为C12H18ON2Cl2 | |
| B. | 该物质可与盐酸反应 | |
| C. | 该物质的核磁共振氢谱图中有8个吸收峰 | |
| D. | 该物质能发生的类型有:加成反应、酯化反应、消去反应、氧化反应等 |
| A. | 用移液管移取10 mL NaOH溶液放于锥形瓶中,移液管的尖嘴和锥形瓶内壁一定要接触 | |
| B. | 实验室制硝基苯时,先将硝酸与浓硫酸混合,冷却后边振荡边滴加苯 | |
| C. | 制备硝酸钾晶体实验中先后进行了二次过滤,分别是先常温减压过滤、后高温常压过滤 | |
| D. | 受溴腐蚀致伤:先用苯或甘油洗伤口,再用水洗 |
| A. | 甲烷 | B. | 乙烯 | C. | 乙醇 | D. | 苯 |
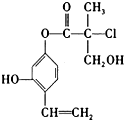
| A. | 1mol A最多可以与2mol Br2发生反应 | |
| B. | A在一定条件下可以发生消去反应和取代反应 | |
| C. | 一个A分子中最多有8个碳原子在同一平面上 | |
| D. | 1mol A与足量的NaOH溶液反应,最多可以消耗3mol NaOH |
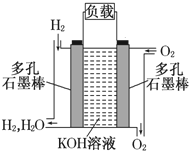 如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从两极通入燃料电池时,便可在闭合回路中不断地产生电流.这被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高率的特点.试回答下列问题:
如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从两极通入燃料电池时,便可在闭合回路中不断地产生电流.这被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高率的特点.试回答下列问题: