题目内容
5.运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.(1)合成氨反应N2(g)+3H2(g)?2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,
平衡向左移动(填”向左”、”向右”或”不”);使用催化剂反应的△H不改变(填”增大”、”减小”或”不改变”).
(2)已知:O2(g)?O2+(g)+e-△H1=+1175.7kJ•mol-1
PtF6(g)+e-?PtF6-(g)△H2=-771.1kJ•mol-1
O2+PtF6-(s)?O2+(g)+PtF6-(g)△H3=+482.2kJ•mol-1
则反应O2(g)+PtF6(g)?O2+PtF6-(s)的△H=-77.6 kJ•mol-1.
(3)在25℃下,向浓度均为0.1mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成沉淀Cu(OH)2(填化学式),生成该沉淀的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+.已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20.
分析 (1)恒压条件下向平衡体系中通入氩气,体积增大,平衡向逆方向移动;催化剂对反应热不影响;
(2)利用盖斯定律解答,从待求反应出发,分析待求反应中的反应物和生成物在已知反应中的位置,通过相互加减可得;
(3)难溶电解质的溶度积越小,加入氨水时越易生成沉淀.
解答 解:(1)恒压条件下向平衡体系中通入氩气,体积增大,平衡向左移动;加入催化剂,只改变反应的活化能,但反应热不变;
故答案为:向左;不改变;
(2)已知:
①O2(g)=O2+(g)+e-△H1=+1175.7kJ•mol-1
②PtF6(g)+e-=PtF6-(g)△H2=-771.1kJ•mol-1
③O2PtF6(S)=O2+(g)+PtF6-(g)△H3=+482.2kJ•mol-1
据盖斯定律,①+②-③得:O2(g)+PtF6(g)=O2PtF6(s)△H=-77.6 kJ•mol-1,
故答案为:-77.6 kJ•mol-1;
(3)难溶电解质的溶度积越小,加入氨水时越易生成沉淀,则生成的沉淀为Cu(OH)2,反应的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,
故答案为:Cu(OH)2;Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+.
点评 本题考查了化学平衡影响因素,盖斯定律的应用以及Ksp的计算,根据溶度积常数确定先沉淀的物质,溶度积常数越小的物质越先沉淀,铜离子和氨水反应生成氢氧化铜和铵根离子,题目难度中等.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
15.下表是某“加碘食盐”包装袋上的部分文字说明.
(1)经测定,该“加碘食盐”中KIO3的含量为42.8mg•kg-1.计算每千克“加碘食盐”中KIO3的物质的量为多少?该“加碘食盐”的含碘量为多少?.
(2)将5.0g该“加碘食盐”溶于水中配成100mL溶液,该溶液中IO${\;}_{3}^{-}$离子物质的量浓度为多少?
| 配料 | 氯化钠(NaCl)、碘酸钾(KIO3) |
| 含碘量 | 20~40mg•kg-1 |
| 保质期 | 18个月 |
| 食用方法 | 勿长时间炖炒 |
| 贮藏指南 | 避热、避光、密封、防潮 |
(2)将5.0g该“加碘食盐”溶于水中配成100mL溶液,该溶液中IO${\;}_{3}^{-}$离子物质的量浓度为多少?
16.下列反应的离子方程式不正确的是( )
| A. | 氨气通入稀硫酸中:NH3+H+═NH4+ | |
| B. | 小苏打溶液和烧碱溶液反应:HCO3-+2OH-═CO32-+H2O | |
| C. | 一小块金属钠投入水中:Na+2H2O═Na++OH-+H2↑ | |
| D. | 澄清石灰水中加入过量硝酸:H++OH-═H2O |
10.短周期元素X、Y、Z在周期表中位置关系如图:
(答题时,X、Y、Z用所对应的元素符号表示)
(1)x元素的单质分子式是He,单质是原子晶体.
(2)自然界中存在一种仅含钙与Y两种元素的天然矿物,其电子式为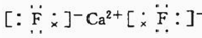 ,属于离子晶体.
,属于离子晶体.
(3)Z的氢化物和Y的氢化物沸点高低顺序是:HF>H2S,理由:HF分子之间除了存在分子间作用力,还存在氢键.
(4)X、Y、Z三种元素中,电负性最大的是:F.
| X | ||
| Y | ||
| Z |
(1)x元素的单质分子式是He,单质是原子晶体.
(2)自然界中存在一种仅含钙与Y两种元素的天然矿物,其电子式为
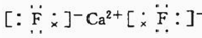 ,属于离子晶体.
,属于离子晶体.(3)Z的氢化物和Y的氢化物沸点高低顺序是:HF>H2S,理由:HF分子之间除了存在分子间作用力,还存在氢键.
(4)X、Y、Z三种元素中,电负性最大的是:F.
17.有关晶体结构的叙述中,错误的是( )
| A. | 分子晶体中相对分子质量大的熔、沸点一定比相对分子质量小的高 | |
| B. | 在氯化钠晶体中,每个氯离子周围都紧邻12个氯离子 | |
| C. | 在金属铜的晶体中,由于存在自由电子,因此铜能导电 | |
| D. | 金刚石的网状结构中,最小的环上有6个碳原子 |
14.下列说法不正确的是( )
| A. | 用移液管移取10 mL NaOH溶液放于锥形瓶中,移液管的尖嘴和锥形瓶内壁一定要接触 | |
| B. | 实验室制硝基苯时,先将硝酸与浓硫酸混合,冷却后边振荡边滴加苯 | |
| C. | 制备硝酸钾晶体实验中先后进行了二次过滤,分别是先常温减压过滤、后高温常压过滤 | |
| D. | 受溴腐蚀致伤:先用苯或甘油洗伤口,再用水洗 |
15.把VL含(NH4)2SO4和NH4Cl的混合溶液分为两等份,一份加入a mol烧碱并加热,恰好把全部NH3赶出;另一份加入含b mol BaCl2的溶液,使沉淀反应刚好完全.原溶液中Cl-的物质的量浓度(mol/L)为( )
| A. | (2a-b)/V | B. | (2a-4b)/V | C. | (b-2a)/V | D. | (a-4b)/V |
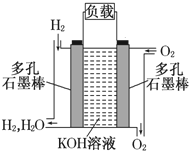 如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从两极通入燃料电池时,便可在闭合回路中不断地产生电流.这被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高率的特点.试回答下列问题:
如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从两极通入燃料电池时,便可在闭合回路中不断地产生电流.这被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高率的特点.试回答下列问题: