题目内容
14.已知:C(s)+2H2(g)→CH4(g)△H1C(s)+$\frac{1}{2}$H2(g)→$\frac{1}{2}$C2H2(g)△H2
C(s)+H2(g)→$\frac{1}{2}$C2H4(g)△H3
C2H2(g)+H2(g)→C2H4(g)△H4=-26KJ•mol-1
$\frac{1}{2}$C2H4(g)+H2(g)→CH4(g)△H5=-20KJ•mol-1
下列关系正确的是( )
| A. | △H1>△H2 | B. | △H1>△H3 | C. | △H2>△H3 | D. | △H3>△H1>△H2 |
分析 a.C2H2(g)+H2(g)→C2H4(g)△H4=-26KJ•mol-1,焓变是负值,该反应是放热反应
b.$\frac{1}{2}$C2H4(g)+H2(g)→CH4(g)△H5=-20KJ•mol-1,焓变是负值,该反应是放热反应,
①C(s)+2H2(g)=CH4(g)△H1;
②C(s)+$\frac{1}{2}$H2(g)→$\frac{1}{2}$C2H2(g)△H2;
③C(s)+H2(g)→$\frac{1}{2}$C2H4(g)△H3
根据盖斯定律结合①②③方程式与a、b关系分析判断.
解答 解:a.C2H2(g)+H2(g)→C2H4(g)△H4=-26KJ•mol-1,焓变是负值,该反应是放热反应
b.$\frac{1}{2}$C2H4(g)+H2(g)→CH4(g)△H5=-20KJ•mol-1,焓变是负值,该反应是放热反应,
①C(s)+2H2(g)=CH4(g)△H1;
②C(s)+$\frac{1}{2}$H2(g)→$\frac{1}{2}$C2H2(g)△H2;
③C(s)+H2(g)→$\frac{1}{2}$C2H4(g)△H3
利用盖斯定律,2×(③-②),得到C2H2(g)+H2(g)═C2H4(g)△H=2×(△H3-△H2)<0,
所以△H3<△H2;
同理:(①-③),得到$\frac{1}{2}$C2H4(g)+H2(g)→CH4(g)△H5=(△H1-△H3)=-20KJ•mol-1,则△H1-△H3<0,
所以△H1<△H3;
则△H1<△H3<△H2,
故选C.
点评 本题主要考查了盖斯定律的运用,注意利用题目中的条件及把握反应方程式的关系,注意根据方程式△H的正负号分析,题目难度中等,侧重于考查学生的分析能力和计算能力.

| A. | 0.5mol/L NaOH溶液 | B. | 0.5mol/L HCl溶液 | ||
| C. | 0.5mol/L CH3COOH溶液 | D. | 0.5mol/L NaCl溶液 |
| A. | 5mol•L-1 | B. | 6.25mol•L-1 | C. | 7mol•L-1 | D. | 6.75mol•L-1 |
| A. | 9.82mol•L-1 | B. | 4.91mol•L-1 | C. | 2.13mol•L-1 | D. | 1.12mol•L-1 |
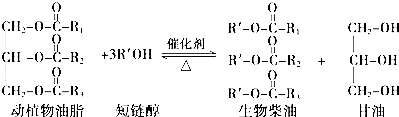
| A. | 生物柴油由可再生资源制得 | B. | 生物柴油是不同酯组成的混合物 | ||
| C. | “地沟油”可用于制备生物柴油 | D. | 动植物油脂与醇的反应是皂化反应 |

| A. | NO2 | B. | NO | C. | SO2 | D. | NH3 |
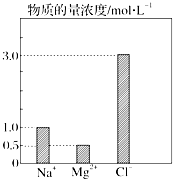 在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示.请回答下列问题:
在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示.请回答下列问题: