题目内容
9.在一定条件下,动植物油脂与醇反应可制备生物柴油,化学方程式如下:下列叙述错误的是( )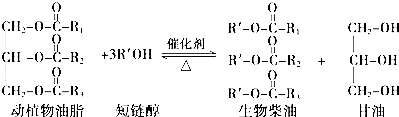
| A. | 生物柴油由可再生资源制得 | B. | 生物柴油是不同酯组成的混合物 | ||
| C. | “地沟油”可用于制备生物柴油 | D. | 动植物油脂与醇的反应是皂化反应 |
分析 A.生物柴油其原料取自可再生的动植物资源;
B.生物柴油是指以动植物油脂为原料生产的、以脂肪酸甲酯为主要成份的液体燃料;
C.“地沟油”中含有动植物油脂,动植物油脂与醇反应可制备生物柴油;
D.皂化反应是指油脂在碱性条件下的水解反应.
解答 解:A.生物柴油由可再生资源制得,故A正确;
B.生物柴油通常是指以动植物油脂为原料生产的、以不同脂肪酸甲酯组成的混合物,故B正确;
C.“地沟油”中含有动植物油脂,动植物油脂与醇反应可制备生物柴油,故C正确;
D.油脂在碱存在的条件下水解,水解生成的高级脂肪酸与碱反应,生成高级脂肪酸盐,这样的水解反应叫做皂化反应,动植物油脂与醇的反应属于酯化反应,故D错误;
故选:D.
点评 本题主要考查了油脂的性质与用途,熟悉油脂结构及性质是解题关键,注意皂化反应的实质是高级脂肪酸甘油酯的水解反应,题目难度不大.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
14.已知:C(s)+2H2(g)→CH4(g)△H1
C(s)+$\frac{1}{2}$H2(g)→$\frac{1}{2}$C2H2(g)△H2
C(s)+H2(g)→$\frac{1}{2}$C2H4(g)△H3
C2H2(g)+H2(g)→C2H4(g)△H4=-26KJ•mol-1
$\frac{1}{2}$C2H4(g)+H2(g)→CH4(g)△H5=-20KJ•mol-1
下列关系正确的是( )
C(s)+$\frac{1}{2}$H2(g)→$\frac{1}{2}$C2H2(g)△H2
C(s)+H2(g)→$\frac{1}{2}$C2H4(g)△H3
C2H2(g)+H2(g)→C2H4(g)△H4=-26KJ•mol-1
$\frac{1}{2}$C2H4(g)+H2(g)→CH4(g)△H5=-20KJ•mol-1
下列关系正确的是( )
| A. | △H1>△H2 | B. | △H1>△H3 | C. | △H2>△H3 | D. | △H3>△H1>△H2 |
4.葡萄糖酸锌[(C6H11O6O)2Zn]是一种营养锌强化剂,对婴儿及青少年的智力和身体发育有重要作用.工业上通过如下两步制备:

(1)步骤一:充分反应后,过滤除去CaSO4沉淀.设计一个简单的实验,检验产物葡萄糖酸溶液中是否含有SO42-:取少量溶液于试管中,滴加BaCl2溶液,若产生白色沉淀,则说明含有SO42-;反之,说明不含SO42-.
(2)步骤二:将葡萄糖酸溶液与ZnO混合,使其充分反应后,继续加入葡萄糖酸溶液至pH为5.8,其目的是抑制Zn2+的水解,下列物质可替代ZnO的是b(填字母).
a.NH3•H2O b.Zn(OH)2 c.NaOH d.ZnSO4
(3)将最后所得溶液浓缩至原来体积的$\frac{1}{3}$,加入适量无水乙醇,放置8h以上,经结晶、分离、干燥获得葡萄糖酸锌晶体.分离过程中加入无水乙醇的目的是降低葡萄糖酸锌的溶解度,有利于其结晶析出.
(4)下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
某研究性学习小组欲用粗制硫酸锌溶液(其中含有Fe2+、Cu2+等)制备出活性ZnO,然后再合成葡萄糖酸锌.实验室制备活性ZnO的步骤如下:
①取样,加入适量的KMnO4溶液,微热,调节溶液pH至3.2~5.2(填写范围),除去溶液中Fe元素.
②加入过量的锌粉,过滤,向滤渣中加入适量稀硫酸,继续过滤,将两次滤液合并得较高纯度的硫酸锌溶液.
③将纯碱慢慢加入上述硫酸锌溶液中,得碱式碳酸锌[其化学式为Zn2(OH)2CO3],同时有无色气体产生.写出该反应的离子方程式:2CO32-+2Zn2++H2O=Zn2(OH)2CO3↓+CO2↑.
④过滤、洗涤,将沉淀灼烧得活性氧化锌.其中灼烧需要的主要仪器有:酒精灯、玻璃棒、三脚架、泥三角、坩埚、坩埚钳等.

(1)步骤一:充分反应后,过滤除去CaSO4沉淀.设计一个简单的实验,检验产物葡萄糖酸溶液中是否含有SO42-:取少量溶液于试管中,滴加BaCl2溶液,若产生白色沉淀,则说明含有SO42-;反之,说明不含SO42-.
(2)步骤二:将葡萄糖酸溶液与ZnO混合,使其充分反应后,继续加入葡萄糖酸溶液至pH为5.8,其目的是抑制Zn2+的水解,下列物质可替代ZnO的是b(填字母).
a.NH3•H2O b.Zn(OH)2 c.NaOH d.ZnSO4
(3)将最后所得溶液浓缩至原来体积的$\frac{1}{3}$,加入适量无水乙醇,放置8h以上,经结晶、分离、干燥获得葡萄糖酸锌晶体.分离过程中加入无水乙醇的目的是降低葡萄糖酸锌的溶解度,有利于其结晶析出.
(4)下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 5.2 | 6.4 |
①取样,加入适量的KMnO4溶液,微热,调节溶液pH至3.2~5.2(填写范围),除去溶液中Fe元素.
②加入过量的锌粉,过滤,向滤渣中加入适量稀硫酸,继续过滤,将两次滤液合并得较高纯度的硫酸锌溶液.
③将纯碱慢慢加入上述硫酸锌溶液中,得碱式碳酸锌[其化学式为Zn2(OH)2CO3],同时有无色气体产生.写出该反应的离子方程式:2CO32-+2Zn2++H2O=Zn2(OH)2CO3↓+CO2↑.
④过滤、洗涤,将沉淀灼烧得活性氧化锌.其中灼烧需要的主要仪器有:酒精灯、玻璃棒、三脚架、泥三角、坩埚、坩埚钳等.
14.下列物质在一定条件下均能产生氧气,其中最适合用于宇航员(宇航员呼吸所需的氧气主要来自太空服中的呼吸面具)出舱时的供氧剂的是( )
| A. | HNO3 | B. | H2O2 | C. | KClO3 | D. | Na2O2 |
1.下列说法正确的是( )
| A. | 氯化铁溶液有较强氧化性,故可用作净水剂 | |
| B. | 煤中含有大量的有机物,用干馏的方法通过发生物理变化得到产物 | |
| C. | 除去CH4中的少量C2H4:通过盛有酸性高锰酸钾溶液的洗气瓶 | |
| D. | 将ag铜丝灼烧成黑色后趁热插入乙醇中,铜丝变红,再次称量质量等于a g |
18.下列溶液中,物质的量浓度最大的是( )
| A. | 将40 g NaOH溶于水并配成1 L的溶液 | |
| B. | 0.5 L含49 g H2SO4的溶液 | |
| C. | 将1mol Na2O 溶于水并配成1 L的溶液 | |
| D. | 含K+为1mol•L-1的K2SO4溶液 |

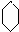 ;名称是环己烷.
;名称是环己烷.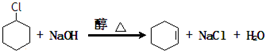 .
.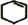 +Br2→
+Br2→ .
.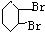 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$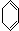 +2NaBr+2H2O.
+2NaBr+2H2O.