题目内容
2.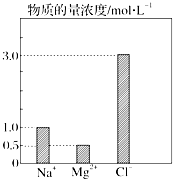 在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示.请回答下列问题:
在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示.请回答下列问题:(1)该混合液中,NaCl的物质的量为0.2mol,含溶质MgCl2的质量为9.5g.
(2)该混合液中CaCl2的物质的量为0.1mol,将该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为0.1mol•L-1;
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀0.6mol.
分析 (1)由图可知,c(Na+)=1.0mol/L,c(Mg2+)=0.5mol/L,结合n=cV、m=nM计算;
(2)结合电荷守恒计算c(Ca2+),结合n=cV、c=$\frac{n}{V}$计算;
(3)加入足量硝酸酸化的硝酸银溶液,氯离子转化为AgCl沉淀.
解答 解:(1)由图可知,c(Na+)=1.0mol/L,该混合液中,NaCl的物质的量为0.2L×1.0mol/L=0.2mol;c(Mg2+)=0.5mol/L,含溶质MgCl2的质量为0.2L×0.5mol/L×95g/mol=9.5g,
故答案为:0.2;9.5;
(2)由电荷守恒可知2c(Ca2+)+c(Na+)+2c(Mg2+)=c(Cl-),解得:c(Ca2+)=$\frac{3.0-1.0-0.5×2}{2}$=0.5mol/L,混合液中CaCl2的物质的量为:0.2L×0.5mol/L=0.1mol,该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为:c=$\frac{0.1mol}{1L}$=0.1mol/L,
故答案为:0.1;0.1;
(3)加入足量硝酸酸化的硝酸银溶液,氯离子转化为AgCl沉淀,n(AgCl)=n(Cl-)=3mol/L×0.2L=0.6mol,
故答案为:0.6.
点评 本题考查了物质的量、物质的量浓度的计算,题目浓度中等,明确稀释过程中溶质的物质的量不变及电荷守恒的应用方法为解答关键,注意熟练掌握物质的量浓度概念及计算方法.

练习册系列答案
相关题目
12.甲烷和一氧化碳的混合气体对氢气的相对密度为10,则该混合气体中CH4和CO分子数之比为( )
| A. | 1:2 | B. | 2:1 | C. | 1:1 | D. | 3:2 |
7.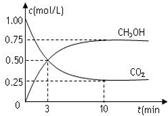 在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法错误的是( )
在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法错误的是( )
 在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法错误的是( )
在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法错误的是( )| A. | 该密闭容器的体积为1L | |
| B. | 反应达平衡,氢气的转化率为0.75 | |
| C. | 反应达平衡,氢气平均反应速率0.075mol/(L•min) | |
| D. | CO2或H2O物质的量不再改变时反应达平衡 |
14.已知:C(s)+2H2(g)→CH4(g)△H1
C(s)+$\frac{1}{2}$H2(g)→$\frac{1}{2}$C2H2(g)△H2
C(s)+H2(g)→$\frac{1}{2}$C2H4(g)△H3
C2H2(g)+H2(g)→C2H4(g)△H4=-26KJ•mol-1
$\frac{1}{2}$C2H4(g)+H2(g)→CH4(g)△H5=-20KJ•mol-1
下列关系正确的是( )
C(s)+$\frac{1}{2}$H2(g)→$\frac{1}{2}$C2H2(g)△H2
C(s)+H2(g)→$\frac{1}{2}$C2H4(g)△H3
C2H2(g)+H2(g)→C2H4(g)△H4=-26KJ•mol-1
$\frac{1}{2}$C2H4(g)+H2(g)→CH4(g)△H5=-20KJ•mol-1
下列关系正确的是( )
| A. | △H1>△H2 | B. | △H1>△H3 | C. | △H2>△H3 | D. | △H3>△H1>△H2 |
18.下列溶液中,物质的量浓度最大的是( )
| A. | 将40 g NaOH溶于水并配成1 L的溶液 | |
| B. | 0.5 L含49 g H2SO4的溶液 | |
| C. | 将1mol Na2O 溶于水并配成1 L的溶液 | |
| D. | 含K+为1mol•L-1的K2SO4溶液 |
