题目内容
16.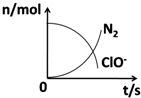 在一个氧化还原反应的体系中,共有H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
在一个氧化还原反应的体系中,共有H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )| A. | 还原剂是含CN-的物质,氧化产物只有N2 | |
| B. | 氧化剂是ClO-,还原产物是HCO3- | |
| C. | 配平后氧化剂与还原剂的化学计量数之比为4:1 | |
| D. | 标准状况下,若生成2.24LN2,则转移电子数为NA |
分析 由曲线变化图可知,随反应进行ClO-的物质的量降低,N2的物质的量增大,故ClO-为反应物,N2是生成物,根据电子转移相等可知,CN-是反应物,由氯元素守恒可知Cl-是生成物,由碳元素守恒可知HCO3-是生成物,由氢元素守恒可知H2O是反应物.反应中Cl元素化合价由+1价降低为-1价,化合价总共降低2价,C元素化合价由+2价升高为+4价,N元素化合价由-3价升高为0价,化合价升降最小公倍数为2[(4-2)+(3-0)]=10价,故CN-系数为2,ClO-系数为5,由元素守恒可知HCO3-系数为2,N2系数为1,Cl-系数为5,H2O系数为1,反应方程式为2CN-+5ClO-+H2O=2HCO3-+N2↑+5Cl-.
解答 解:由曲线变化图可知,随反应进行ClO-的物质的量降低,N2的物质的量增大,故ClO-为反应物,N2是生成物,根据电子转移相等可知,CN-是反应物,由氯元素守恒可知Cl-是生成物,由碳元素守恒可知HCO3-是生成物,由氢元素守恒可知H2O是反应物.反应中Cl元素化合价由+1价降低为-1价,化合价总共降低2价,C元素化合价由+2价升高为+4价,N元素化合价由-3价升高为0价,化合价总共升降最小公倍数为2[(4-2)+(3-0)]=10价,故CN-系数为2,ClO-系数为5,由元素守恒可知HCO3-系数为2,N2系数为1,Cl-系数为5,H2O系数为1,反应方程式为2CN-+5ClO-+H2O=2HCO3-+N2↑+5Cl-.
A、反应中,C元素化合价由CN-中+2价升高为HCO3-中+4价,N元素化合价由CN-中-3价升高为N2中0价,可知氧化产物有HCO3-、N2,故A错误;
B、反应中Cl元素化合价由ClO-中+1价降低为Cl-中-1价,ClO-是氧化剂,还原产物是Cl-,故B错误;
C、由上述分析可知,反应为2CN-+5ClO-+H2O=2HCO3-+N2↑+5Cl-,反应中是CN-是还原剂,ClO-是氧化剂,氧化剂与还原剂的化学计量数之比为5:2,故C错误;
D、2.24LN2(标准状况)的物质的量为0.1mol,所以参加反应的ClO-的物质的量为0.5mol,反应中只有氯元素化合价降低,由ClO-中+1价降低为Cl-中-1价,所以转移电子数为0.5mol×2×NAmol-1=NA,故D正确.
故选:D.
点评 本题考查氧化还原反应计算、基本概念等,难度中等,根据曲线变化图分析反应物、产物,利用守恒生成方程式是关键.

 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案| A. | 等于p% | B. | 大于p% | C. | 小于p% | D. | 无法判断 |
| A. | 电解饱和食盐水制得金属Na | B. | 电解熔融MgCl2制得金属Mg | ||
| C. | 高温下CO还原赤铁矿可用于炼铁 | D. | 高温下焦炭还原二氧化硅制得粗硅 |
| A. | 标准状况下,22.4L CH3OH所含中子数为14NA | |
| B. | 常温常压下,1mol Na2CO3所含CO32-的数目等于NA | |
| C. | 56g Fe与足量水蒸气反应,转移的电子数目为$\frac{8}{3}$NA | |
| D. | 1L pH=0的H2SO4所含H+数目为NA |
| A. | 该气体分子的摩尔质量为$\frac{22.4m}{{V}_{1}}$g/mol | |
| B. | 该气体分子中含有的原子数目为$\frac{{N}_{A}{V}_{1}}{22.4}$g/mol | |
| C. | 该气体溶于水后得到溶液的物质的量浓度为$\frac{m}{M{V}_{2}}$mol/L | |
| D. | 该气体溶于水后得到溶液的物质的量浓度$\frac{{V}_{1}}{22.4{V}_{2}}$mol/L |
 氨气是一种重要工业原料,在工农业生产中具有重要的应用.
氨气是一种重要工业原料,在工农业生产中具有重要的应用.